Определение неблагоприятных явлений на применение лекарственных средств
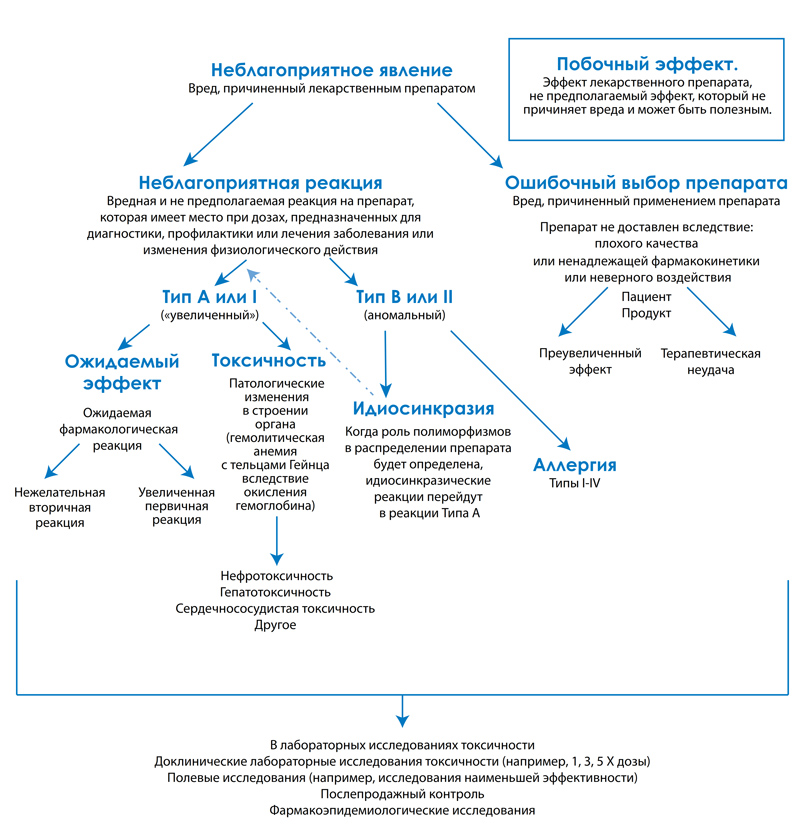
Неблагоприятная реакция на применение лекарственного средства (ADE) относится к любому вреду, вызванному терапевтическим или профилактическим (диагностическим) вмешательством. Они могут быть далее подразделены и включают в себя ошибочный выбор препарата и неблагоприятные реакции на препарат (ADR; см. последнюю страницу). Ошибочный выбор препарата представляет собой ADE, которая является результатом ошибки лица, обслуживающего больного, включая, в том числе, введение неверного препарата, дозы, интервал или путь введения не тому пациенту.
Adverse drug event (ADE) – Неблагоприятное явление на лекарственное средство
Adverse drug reaction (ADR) – Неблагоприятная реакция на препарат
В отличие от ошибочного выбора препарата неблагоприятные реакции на препарат (ADR) относятся к вредной или непредусмотренной реакции на препарат или иное лекарственное средство, которая происходит на дозировку, данную для достижения предполагаемого действия средства. Соответственно, термин ADR подразумевает реакцию, которая может причинить серьезный вред пациенту и, таким образом, отражает реакцию на свойства препарата.
ADR может отражать фармакодинамическую реакцию или фармакокинетический эффект.
ADR следует противопоставлять термину «побочный эффект», относящемуся к эффекту, который не причиняет вреда. В действительности побочный эффект может быть нежелательным или не имеющим последствий для здоровья пациента. Подобно неблагоприятным реакциям Типа А (см. ниже), побочные эффекты обычно прогнозируемы и зависят от дозы.
Неблагоприятные реакции на препарат могут быть далее классифицированы как тип А (Тип I) или тип В (Тип II).
Неблагоприятные реакции типа А («усиленные») или Типа I обычно являются результатом концентраций препарата в месте (обычно оцениваемые концентрациями препарата в плазме [КПП], которая превышает максимальную или падает ниже минимального терапевтического значения). Если врач знает препарат и пациента, реакции типа А в значительной степени прогнозируемы и, соответственно, их можно избежать. Обычно Тип А проявляется в виде увеличенной, но нормальной или ожидаемой фармакологической реакции на препарат. Подобно побочному эффекту, ADR может быть увеличенной первичной или желаемой реакцией (например, брадикардия у пациента, получающего пропланолол для замедления синусовой тахикардии), но также могут отражать нежелательную, вторичную реакцию в результате фармакологических действий препарата (например, бронхоспазмы, вызванные эффектами блокады пропранолола). Некоторые препараты также вызывают неблагоприятные явления, не связанные с их фармакологической реакцией. Эти реакции обычно отражают повреждение целевых клеток и в данной главе называются цитотоксичными неблагоприятными реакциями.Цитотоксичные неблагоприятные реакции, возможно, лучше всего иллюстрируются почечной токсичностью, вызванной аминогликозидами или некрозом печени, или метгемоглобинемией, вызванной ацетаминофеном. Часто именно метаболит препарата, а не сам препарат вызывает цитотоксичность. В таких случаях препараты, вызывающие метаболизм, в частности в печени (например, фенобарбитал, фенитоин), могут повышать риск токсичности, в то время как препараты, уменьшающие метаболизм, снижают риск токсичности (например, циметидин). Цитоксичные реакции на препараты можно лечить препаратами, которые удаляют радикальные метаболиты (т.е. N-ацетилцистеин, предшественник глютатиона).
В отличие от реакций типа А. реакции типа В («необычные») не зависят от дозы или концентрации. В результате эти реакции непредсказуемы, и в значительной степени их невозможно избежать. Они происходят лишь у небольшого числа пациентов, получающих препарат; в человеческой медицине они составляют лишь примерно 6 – 12% всех ADR.
В целом их частота, фактически их существование, часто не фиксируется, пока препарат не начинает широко применяться. Кроме того, так как причина их недостаточно понятна, лечение обычно ограничивается симптоматической терапией.
Примерами неблагоприятных реакций типа В является аллергия на препарат или «непереносимость». Многие случаи непереносимости в конечном итоге могут быть генетически или иным образом обоснованы (т.е. полиморфизм при переносе или белки, метаболизирующие препараты [токсичность ивермектина у колли]), но причину все еще предстоит определить, и, таким образом, реакция не может быть предсказана. Как и в типе А, реакции типа В происходят в ответ на исходное лекарственное вещество или его метаболит.
Принципы лекарственной токсичности
На вероятность неблагоприятной и, в частности, токсической реакции могут влиять различные факторы. Органы, наиболее восприимчивые к неблагоприятным реакциям типа А - это обычно органы, подверженные наибольшему воздействию или концентрации препарата. Таким образом, наиболее уязвимы для системных препаратов органы с наибольшим кровотоком и органы, способные концентрировать препараты, такие как печень и почки.
Высоко метаболически активные органы также могут проявлять токсичные эффекты по двум причинам:
- Такие органы зависят от присутствия энергии, и все, что ухудшает поступление энергии (включая кровоток), может привести к нарушению.
- В случае, когда метаболическая активность включает в себя метаболизм соединений, производство потенциально реактивных метаболитов может повысить вероятность цитотоксичности, если эти метаболиты будут взаимодействовать с клеточными структурами.
Органы, наиболее уязвимые к повреждению реакциями типа В - это обычно органы, содержащие ткани, действующие в качестве гаптенов для лекарственной аллергии (например, кожа, кровеобразующие блоки), или ткани, которые фильтруют и улавливают иммунные комплексы (например, клубочки и суставы). Органы, содержащие большое число тучных клеток, также могут проявлять иммунообусловленные реакции (т.е. «шоковые» органы, см. «Аллергические реакции»). Не все неблагоприятные реакции являются клинически значимыми. Иногда реакции не могут быть обнаружены, если их не искать активно. Например, клинические лабораторные исследования могут обнаружить вызванную лекарственными препаратами гепатотоксичность (например, увеличение активности аланиновой трансферазы сыворотки), которая не проявляет клинических симптомов. Многие препараты могут непосредственно вмешиваться или косвенно влиять на клинические лабораторные исследования, включая исследование эндокринной функции. При подозрении на неблагоприятную реакцию на препарат невозможно переоценить значение сообщения о ней (или подозрении на нее) (см. далее). Предрасположенность органа к лекарственной токсичности может изменяться в течение суток, например аминогликозиды и цисплатин (To 2000) проявляют повышение нефротоксичности у людей при введении вечером по сравнению с утром. В отношении аминогликозидов безопасность утром относилась отчасти за счет увеличения уровня гломерулярной фильтрации, которая происходит утром; повышение чувствительности к воспалению, вызванному интерлейкином-6, предполагалось в отношении цисплантина.
Два механизма, которыми лекарственные препараты могут вызывать смерть клеток, представляют собой апоптоз и некроз, каждый из которых обладает четкими морфологическими и биохимическими характеристиками.
Апоптоз представляет собой активный процесс, который характеризуется сжатием клетки, конденсацией ядра и цитоплазмы, хроматической фрагментацией и фагоцитозом.
В противоположность этому некроз представляет собой пассивный процесс, результатом которого является воспаление, связанное с набуханием клеток и органелл, разрывом мембраны плазмы и вытеканием клеточного содержимого во внеклеточную среду.
Так как апоптоз является активным процессом, необходимо поддержание достаточной внутриклеточной энергии; снижение АТФ может вызывать переход апоптического процесса в некротический. Не удивительно, что митохондрии играют роль в апоптозе. Некоторые токсические вещества могут оказывать свое действие, нарушая функцию митохондрий и таким образом, производство АТФ.
Факторы, повышающие риск ADE: фармакогенетическое многообразие
Увеличение генетического многообразия определяется в качестве причины индивидуальных различий реакции на токсины и препараты, которые приводят, соответственно, к областям токсикогенетики и фармакогенетике. Описываются две области: транспортные белки и ферменты, метаболизирующие лекарственные вещества.
.jpg)
Транспортные белки присутствуют во многих тканях, в которых они ответственны за внесение препаратов или, что более часто, вывод их из клеток. Важной транспортной системой является система P-гликопротеина, генный продукт MDR-1, наиболее известный передачей множественной резистентности раковым клеткам (и микробам). Однако эта транспортная система присутствует в нескольких тканях в организме, включая щеточные каемки почечных канальцев и желчные канальцы (ответственные за выведение препарата из организма), мозг (ответственный за недопущение препаратов в центральную нервную систему; недостатки в отборе колли делают их подверженными токсичности ЦНС вследствие воздействия лекарственных препаратов) и другие ткани с гематоэнцефалическим барьером и в воротах инфекции, в том числе во всей нижней части желудочно-кишечного тракта (сокращая пероральную биодоступность лекарственных препаратов). Два транспортных белка P-гликопротеин (P-gp) кодированы генным продуктом MDR1 (PGY1 ) и MDR3 (также называемым MDR2 или/и PGY3); только продукт гена MDR1 считается оказывающим значительное влияние на движение препарата. P-gp действует как эффлюксный насос, перемещая лекарственные средства из внутриклеточных во внеклеточные отделы. Белок переносит большое количество лекарственных средств, которые являются химически расходящимися; далее эти препараты связываются с определенным CYP 450, ответственным за метаболизм препаратов, которые были перенесены. Полиморфизм гена MDR1 и P-pg был отмечен у людей и связан с изменением распределения лекарственных веществ и, таким образом, подверженности неблагоприятным реакциям на препараты. Интересно, что полиморфизм также связан с увеличением риска определенных заболеваний (например, рефрактерные припадки, болезнь Паркинсона, воспалительные кишечные заболевания).
Полиморфизм, отражающий мутационное уничтожение MDR-1, который вызывает нефункциональный Pg-g, зафиксирован у колли и собак соответствующих рабочих пород. Частота уничтожения впечатляюще высока: в США в одном исследовании 35% колли были гомозиготными и 42% гетерозиготными для мутационного уничтожения. Аналогично высокая частота была обнаружена у собак во Франции: 20% колли и родственных пород были гомозиготными для нормального аллеля, 32% гетерозиготными для уничтожения (носитель) и 48% гомозиготными для мутантного аллеля (пострадавшие собаки). Воздействие мутации на безопасность препаратов в больных животных может быть значительным. Субстратная специфичность для P-pg оказывается схожей среди пород, предполагая, что данные человека могут быть использованы для прогнозирования, какие препараты могут вызывать неблагоприятные эффекты у этих пород. Подобно CYP, P-gp подвержен индукции или ингибированию различными лекарственными препаратами, многие из которых являются субстратами для транспортного белка.
N дегенерация у кошек, вызванная фторхинолонами, является другим примером токсичности в результате различий эффлюксных белков и различий в ретинальных белках у конкретных пород. У кошек отсутствует белок, ответственный за эффлюкс фторхинолонов. Аккумулированные препараты становятся фототоксичными после воздействия ультрафиолетового излучения, вызывая повреждение сетчатки. Из препаратов, одобренных к применению у кошек в США и Европе, наиболее токсичным является энрофлоксацин и марбофлоксацином/прадофлоксацином, за которыми следует орбифлоксацин. Заболевание почек может усугубить риск.
Человеческий полиморфизм в метаболических ферментах CYP был связан с терапевтической неудачей в результате слишком быстрого метаболизма препарата и токсических эффектов вследствие уменьшения метаболизма. Как у людей полиморфизм ферментов, метаболизирующих лекарственные препараты, был зафиксирован и у собак, но не так хорошо описан. Различия в реакциях на анестезию, признанные у гончих, идущих по зрению, отражает как различия в распределении лекарственного препарата (в безжировые, в отличие от жировых отделов), так и различия в метаболизме. Цитохромно-опосредованное выведение нескольких анестетиков меньше у борзых по сравнению с другими (не борзыми) собаками; зафиксированные препараты включают в себя тиопентал, тиамилал и метогекситал. Выведение пропотола у борзых в три раза меньше, чем у биглей. Концентрации кетаконазола в плазме в два раза выше, чем ожидалось у борзых в одном исследовании. Кроме того, распределение у борзых целекоксиба, защитного нестероидного противовоспалительного вещества циклооксигеназы-1, указывает на то, что породные отличия могут делать эту породу предрасположенной к неблагоприятным реакциям на препараты.
Полиморфизм в метаболизме целекоксиба был отнесен на счет CYP2D15, для которого были обнаружены три варианта у собак (Paulson et al., 1999). В исследовании 242 биглей, получающих целекоксиб, приблизительно 50% считались эффективными метаболизаторами и 50% плохими метаболизаторами, при этом биодоступность и максимальная концентрация препарата в плазме в последней группе были почти в два раза выше.
Было описано влияние породных различий в фармакокинетических и фармакокинетических рассмотрениях энантиомеров. Например, для многих NSAID S-изомер имеет гораздо большую аффинность для циклооксигеназы-2, но соотношение S-изомера различна у различных пород. Кроме того, породы различаются по своей способности взаимопревращать S-и R-изомеры. Например, хиральная инверсия была описана для кетопрофена у кошек.
Другие описанные полиморфизмы включают в себя тиопурин-метилтрансферазу (TPMT), один из нескольких ферментов, ответственных за метаболизм активного метаболита пропрепарата азатиоприна; полиморфизмы, являющиеся результатом недостатка у человека, были связаны с увеличением токсических эффектов препарата в костном мозге.
Также были продемонстрированы различия у собак: ризеншнауцеры имеют меньше ТРМТ, а аляскинские маламуты значительно больше ТРМТ по сравнению с другими породами собак.
Аллергические реакции на препараты (Тип В или II)
Клинические проявления аллергических реакций на препараты (Тип В (II) ADR) изменяются в зависимости от типа реакции и целевой системы организма. Обычно воздействие препарата должно иметь место независимо от типа реакции, или терапия должна была быть достаточно долгой (т.е. 10-14 дней) для развития аллергической реакции. Однако, существуют исключения, как показывает пример аллергических реакций на сульфаниламиды. Лекарственные препараты обычно имеют слишком малый молекулярный размер, чтобы быть достаточно антигенными. Соответственно, препараты, вызывающие аллергическую реакцию, обычно действуют как гаптены, совалентно соединяясь с тканью организма, которая затем становится антигенной. В результате аллергическая реакция может быть направлена против препарата или ткани.
Аллергические реакции Типа I (немедленные или анафилактические) опосредованы IgE и являются результатом выделения химических медиаторов (например, гистамин, серотонин, эйкозаноиды) из тучных клеток тканей или базофилов. Реакция происходит в течение нескольких минут после приема препарата независимо от дозы. Клинические проявления обычно включают в себя тошноту, рвоту, сердечную недостаточность, тахикардию, отек легких и нейрологические симптомы. Также могут иметь место уртикария и ангионевротический отек. Клинические симптомы могут зависеть от породы и «шокового» органа вида. Шоковый орган обычно представляет собой орган, в котором тучные клетки присутствуют в более значительных количествах. У собак шоковым органом обычно является печень и желудочно-кишечный тракт; у кошек - обычно легкие, при этом клиническим проявлением является сверхострый отек легких. Точный антиген, вызывающий анафилаксию, может быть неизвестен. Анафилаксия у собак с микрофиляриемией после приема микрофилярицидов хорошо зафиксирован, однако, специфический антиген, выделяемый действием препарата, неизвестен (Kitoh et al., 1994). При введении собакам с микрофиляремией и диметилкарбамазин, и ивермектин могут вызывать шок, который проявляется коллапсом периферических сосудов, одышкой, кровавым поносом и другими клиническими симптомами и лабораторными результатами, соответствующими анафилаксии.
Лечение анафилаксии, вызванной лекарственными препаратами, направлено на предотвращение физиологической реакции на выброс медиатора (т.е., эпинефрин и антигистаминные вещества) и предотвращение дальнейшего выброса гистаминов (например, эпинефрин и глюкокортикоиды, возможны антигистаминные средства). Также показана поддерживающая терапия. Лечение на профилактической основе помогает снизить проявления анафилаксии посредством уменьшения реакции тучных клеток.
Лекарственные препараты, связанные с аллергической реакцией Типа I у людей, включают в себя пенициллины, ингибиторы ангиотензинконвертирующих ферментов (в особенности в первые 3 недели терапии), нестероидные противовоспалительные средства (NSAID) и опиоиды. Однако последние препараты могут быть фактически более связаны с реакцией, подобной анафилактической, также называемой анафилактоидной. Эта реакция очень схожа с анафилаксией, но не медиирована IgE (т.е. не является аллергической или иммуноопосредованной); скорее, выбранные препараты вызывают непосредственную дегрануляцию тучных клеток. Обычно эти препараты являются катионоактивными (базовыми) и включают в себя опиоиды (в частности, морфин), полимиксин, рентгенконтрастные вещества, тиацетарсамид и амфотерицин В. Гиперосмолярные растворы, такие как маннитол, также могут вызывать непосредственную дегрануляцию тучных клеток. Анафилактоидные реакции обычно связаны с дозировкой, и введение небольшой контрольной дозы может помочь выявить вероятность их наступления. Также показаны уменьшение скорости введения и описанные ранее профилактические меры.
Реакции Типа II (цитотоксические) имеют место, когда связанные с антителами клетки крови становятся лизированными и выводятся из кровообращения. Лизис происходит вследствие непосредственного связывания IgG или IgM. Комплемент может быть активирован или нет. Мишенью могут быть стволовые клетки костного мозга или зрелые циркулирующие клетки. Воздействие на красные кровяные тельца, лейкоциты и тромбоциты приводит, соответственно, к гемолитической анемии, агранулоцитозу и лейкопении, тромбоцитопении или их сочетанию. Реакции на лекарственные препараты Типа III (заболевание иммунного комплекса или сывороточная болезнь) вызваны комплексом антиген-антитело с участием IgG или IgM и активацией комплемента. Циркулирующие комплексы антиген-антитело могут фильтроваться сосудистой сетью и оседать в сосудистой сети некоторых органов, в том числе почках, центральной нервной системе (ЦНС) или периферических сосудах. Клинические симптомы обычно связаны с основным затронутым органом, но также включают в себя лихорадку и лимфаденопатию. Локальная анафилаксия является изменением реакции типа III и проявляется отеком и болью в месте введения препарата. Среди реакций на лекарственные препараты в ветеринарии, вероятно, наиболее признанной причиной иммуноопосредованных реакций на препараты типа III является усиливающие действие сульфаниламиды.
Реакции на лекарственные препараты Типа IV (аллергическая реакция замедленного типа, клеточно-опосредованная) отражают клеточную реакцию в месте антигена. Лимфоциты и макрофаги инфильтрируют место и вызывают выброс медиатора, который консервирует воспалительную реакцию.
Пример неблагоприятной реакции на лекарственные препараты
СУЛЬФАНИЛАМИДЫ: Тип I. Сульфаниламиды действуют в качестве субстрата и таким образом ингибируют тиреоидную пероксидазу, которая препятствует йодированию гормонов. Синтез тироидных гормонов может быть подавлен при высоких дозах (48 – 60 мг/кг/сутки в течение 6 недель). Антибактериальные средства являются не единственными сульфаниламидами для подавления щитовидной железы; зонисамид в дозировке 12 мг/кг/сутки вызывал подавление у собак.
Тип II. Лекарственные аллергии относятся к неблагоприятным реакциям, связанным с гиперчувствительностью. «Потенцирующее средство» также может быть ответственным за некоторые реакции: триметоприм может быть связан с кожной сыпью или гепатопатией. Гиперчувствительность вызывает реакции во многих тканях организма у многих видов (см. ниже), хотя артропатия чаще встречается у собак крупных пород (в первую очередь доберманов). Сухой кератоконъюнктивит (СКК) является более распространенным побочным эффектом усиленных сульфаниламидов у собак, но может отражать непосредственную цитотоксичность, а не аллергическую реакцию. Частота возникновения более высока, встречается у 15% собак, но может наступить через несколько месяцев или лет после начала терапии. Недостаток n-ацетилирования, имеющий место при метаболизме лекарственных препаратов у собак, может в целом делать собак предрасположенными к сульфаниламидной токсичности. Еще предстоит выяснить, является ли это следствием аккумулирования исходного препарата или производства потенциально токсического альтернативного метаболита. Окисление сульфаниламидов у собак создает гидроксиламин, цитотоксический метаболит, который также может быть причиной токсичности. Потенциальная роль ариламина в качестве причины сульфаниламидной токсичности поддерживается отсутствием токсичности вследствие других сульфаниламидных препаратов, применяемых для собак (например, дераксоциб, фуросемид, зонисамид и ацетазоламид), которые при отсутствии первичного ариламина не превращаются в гидроксиламин. Механизмы гиперчувствительности могут отражать гаптенизацию препарата (или его метаболита) и последующую реакцию Т-клеток, хотя другие механизмы (например, гуморальный ответ или цитотоксичность) могут быть причиной (Trepanier 2004).
| Cox 1:Cox 2 Ratios of selected drugs by investigator |
| Drug |
A |
B |
C |
D |
E |
| Carprofen |
*129 |
6.5/5.5 |
1.7 |
6 |
65 |
| Celocoxib |
|
9 |
|
|
|
| Deracoxib |
|
|
|
12 |
*1275 |
| Etodolac |
0.52 |
|
|
|
3.4 |
| Firocoxib |
|
|
|
|
|
| Meloxicam |
2.9 |
10 |
*12.3 |
*427 |
|
| Ketoprofen |
0.2 |
0.6 |
0.36 |
|
|
| Phenylbutazone |
0.6 |
0.6 |
|
*man. Spons. |
<1 |
NSAIDS: Тип I.
Для рассмотрения безопасности препаратов есть три источника данных при использовании в качестве примера NSAID.
Доклинические исследования могут включать в себя лабораторные исследования, которые могут соответствовать или не соответствовать лабораторной ситуации (например, отношения Cox1:Cox2).
Предрегистрационные данные (исследования токсичности, обычно ограниченные 6-12 собаками, и полевые исследования, охватывающие от 100 до 1 000 пациентов), полученные для подтверждения безопасности в процессе регистрации, представлены на вкладышах упаковки. Сравнение этих данных может показать некоторую дискриминацию между продуктами в отношении относительной безопасности, хотя данные отражают передозировку (ситуация, которая редко клинически актуальна).
Данные (Таблица ниже) предполагают, что тепоксалин является самым безопасным NSAID (на основании ЖК эффектов), за которым следует карпрофен, мелоксикам, фирококсиб, деракоксиб и, наконец, этодалак. Из данных полевых исследований карпрофен (n=900) и деракоксиб были единственными NSAIDS, которых рвота была не более чем плацебо.
| Table 1. Pre-approval toxicity data for new NSAIDs |
| Carprofen |
9 |
5,7 |
52 |
No changes |
| |
|
10 |
14 |
Mild histologic |
| Etodolac |
14 |
5,3 |
36 |
6/8 deaths(3 wks- months) |
| Deracoxib |
9 |
3** |
2-Mar |
NSF/ Jejunal erosions** |
| Firocoxib |
6 to 7 |
5 |
26 |
V/D, ulcer 1/8 |
| Meloxicam |
20 |
5 |
24-Jun |
microscopic |
| Tepoxalin |
1/13** |
20 |
24 |
NSF |
* time to wait before changing NSAIDs would be at least 3 X half-life
** undergoes saturation kinetics at 2.5 X recommended dose ***active metabolite
| FDA Adverse events for Cats |
| Meloxicam |
Carprofen |
| Sign |
(n=497) |
% |
(n=489) |
% |
| Creatinine |
230 |
46 |
109 |
22 |
| Anorexia |
226 |
45 |
138 |
28 |
| BUN |
224 |
45 |
118 |
24 |
| Depression |
200 |
40 |
153 |
31 |
| Vomiting |
166 |
33 |
231 |
47 |
| Renal Failure |
116 |
23 |
28 |
6 |
| Death |
67 |
13 |
45 |
9 |
Ограниченные послепродажные клинические испытания проводятся; многие финансируются фармацевтическими компаниями и должны считаться потенциально предвзятыми. В одном независимом исследовании (Reimer and co workers, JVIN 13:742, 1999) было выявлено, что карпрофен и этодолак (рекомендуемая доза в течение 28 дней) не были связаны с изъязвлением ЖК тракта у собак, в то время как буферный аспирин (15,6 мг/кг) был (в течение 5 дней).
Важнейшим источником данных о реакции на препараты является послепродажный контроль, который обеспечивается врачом (просьба сообщать о неблагоприятных реакциях на лекарственные препараты, которые могут быть рассмотрены на вебсайте FDA (www.fda.gov/cvm/ search adverse event reporting). В качестве примера можно привести сообщения от Новартис(JAVMA 224; 2005:1112) о том, что из 20 собак, у которых развилась перфорированная язва в процессе получения деракоксиба, 90% получали передозировку или другой NSAID, или глюкокотикоид в течение последних 24 часов представления.
ТИП II. Данные о неблагоприятных реакциях показывают, что все NSAID будут вызывать заболевание печени у собак (потенциально более высокий риск почечной недостаточности у кошек, в особенности с мелоксикамом). Так как животные старшего возраста могут обладать меньшей защитной способностью против NSAIDS, следует рассмотреть гепатопротекторы, такие как SAM, n-ацетилцистеин (в особенности при острой гепатопатии) или расторопшу. FDA попросила, чтобы вкладыши в упаковке сопровождались вырезками с Информацией клиента. Клиницисты должны обеспечить получение этой информации всеми клиентами наряду с консультацией в отношении применения NSAID для своего питомца.
Сообщения о неблагоприятных реакциях на лекарственные препараты
Сообщение о ADE в любой стране усложняется проблемой ее идентификации.
В человеческой медицине были определены методы, посредством которых может быть оценена причинно-следственная связь между предполагаемой реакцией и предполагаемым лекарственным средством.
Ни один из них не получил всеобщего признания, но каждый включает в себя некоторые или все следующие критерии: время между введением препарата и наступлением реакции или прекращением препарата и купированием клинических симптомов; ход реакции, который может изменяться, если препарат продолжается или прерван; роль препарата и основное заболевание, лечение которого проводится, как причина реакции; реакция на повторное введение препарата; результаты лабораторных тестов и история предыдущего введения препарата (Benichou and Celigny, 1991).
Определение ADE и передача этой информации ветеринарным специалистам могут представлять трудность, в особенности для человеческих препаратов, не утвержденных для применения на животных. В Соединенных Штатах, хотя исследования безопасности являются необходимым шагом для получения разрешения Управления по контролю за продуктами и лекарствами в отношении всех человеческих лекарств, основной акцент исследований животных делается на основе безопасности использования препаратов для человека, и аналогичная ситуация может существовать во всех странах. Информация о безопасности препаратов часто считается собственностью компании и может не предоставляться даже по требованию. Кроме того, исследования у людей и животных, направленные на обнаружение токсичности, обычно проводятся у здоровых пациентов, размер выборки очень мал относительно населения, которое будет применять данный препарат. Таким образом, часто ADE на утвержденные препараты может не выявляться, пока препарат не получит широкого распространения (т.е. после того, как препарат не выйдет на рынок). Но и тогда о ADE могут не сообщать. Например, лекарственный препарат, характеризующийся неблагоприятными реакциями у 0,03% населения, потребовал бы исследования 10 000 человек для выявления реакции у 3 из них. Так как реакция может быть не признана неблагоприятной (например, может быть ошибочно принята за заболевание) или не связана с применением лекарственного препарата, могут отсутствовать сообщения о ADE. Существует вероятность, что при использовании препарата трудно выявить, какой препарат ответственен за реакцию.
В случае обнаружения реакции, о ней необходимо сообщить, чтобы связь между препаратом и побочным эффектом могла стать известной членам профессии.
Сообщений о неблагоприятных реакциях в Центр ветеринарной медицины (CVM) Управления по контролю за продуктами и лекарствами (FDA) стало заметно больше (с 4 000 в 1997 году до почти 25 000 в год в последние несколько лет). Это увеличение отражает отчасти популярность и прозрачность программы отчетности CVM, которая сопровождала улучшения в сборе, анализе и отчетности о неблагоприятных реакциях.
Передача сообщений о неблагоприятных реакциях на препарат возможна по нескольким каналам. Ветеринарная фармацевтическая компания может быть непосредственно проинформирована через обращение к сотруднику по Медицинским вопросам; по закону о таких неблагоприятных реакциях необходимо сообщать в Центр ветеринарной медицины Управления по контролю за продуктами и лекарствами. Последствия сообщения о ADE животного на человеческий препарат неясны, но обязательное сообщение едва ли вероятно.
В таких ситуациях следует использовать второй путь: Центр ветеринарной медицины (ЦВМ) предоставляет указания для сообщения о ADE - форму (FORM FDA 1932a, «Отрицательный ветеринарный опыт: Доклад об отсутствии эффективности или дефекте продукта») можно загрузить или распечатать с http://www.fda.gov/cvm/adereporting.htm.
Или написать по адресу: ADE Reporting System, Center for Veterinary Medicine, U.S. Food & Drug Administration, 7500 Standish Place, Rockville, MD 20855-2773). Сообщения также можно передать по телефону 1-888-FDA-VETS.
В последнее время подход ЦВМ к оценке потенциальных ADE подвергся критике, так как ведет к изменениям этикетки препарата или вообще к его отзыву с рынка. Методы анализа могут быть переоценены, что, хочется надеяться, далее усовершенствует процесс оценки и повысит точность. Результаты программы отчетности о ADE и анализа ЦВМ можно посмотреть по каждому препарату в приведенной выше URL.
| Table 1. Examples of drugs inducing toxicity in dogs or cats |
| Hepatotoxicity |
Nephrotoxicity |
Ototoxicity |
Hematologic |
Dermatologic |
| Acetaminophen |
Acyclovir |
streptomycin |
Acetaminophen |
Ampicillin |
| Anabolic steroids† |
Aminoglycosides |
amkicin |
Anticancer drugs |
Anticancer drugs |
| Aspirin |
Amphotericin B |
gentamicin |
Azodye (urinary antiseptics) |
Bromide |
| Carprofen |
ACE inhibitors |
netilmicin |
Benzocaine (and related drugs) |
Coal tar shampoos |
| Deoxycholic acid |
Bacitracin |
kanamycin |
Chloramphenicol |
Chloramphenicol |
| Deracoxcib |
Carboplatin |
tobramycin |
Cimetidine |
Diethylcarbamazine |
| Diazepam (cats) |
Cephaloridine |
polymixin |
Coumarin derivatives |
Human recombinant ERP |
| Etodolact |
Cisplatin |
erythromycin |
Human recombinant ERP |
Flea collars |
| Glucocorticoids |
Colistin |
colistin |
Estrogens |
5-Fluorocytosine |
| Griseofulvin (cats) |
Cyclosporine (humans) |
chloramphenicol |
Griseofulvin |
Glucocorticoids |
| Halothane (?) |
Foscanart |
minocycline |
Heparin |
Gold-containing drugs |
| Isoniazid |
Gangciclovir |
vancomycin |
Methimazole |
Griseofulvin |
| Ketoconazole |
Iodine radiologic contrast dyes (IV) |
ethanol |
Methylene blue |
Hetacillin |
| Mebendazole |
Methoxyflurane |
benzalkonium chloride |
NSAIDs |
Levamisole |
| Megestrole acetate (cats) |
NSAIDs |
chlorhexidine |
Phenobarbital |
Lime sulfur dips |
| Melarsomine |
Polymixin B |
iodine |
Phenylbutazone |
Neomycin (topical) |
| Methotrexate |
Sulfonamides |
iodophores |
Propylthiouracil |
Phenothiazine derivatives |
| Methoxyflurane |
Tetracyclines |
furosemide |
Ranitidine |
Phenytoin |
| Mibolerone |
Thiacetarsamide |
cisplatin |
|
Prednisone |
| Nonsteroidal Antiinfllamtories |
Vancomycin (low) |
salicylates |
|
Quinidine |
| Oxibendazole |
|
propylene glycol |
|
Sulfonamides |
| Phenobarbital |
|
detergens |
|
Tetracyclines (oral) |
| Phenytoin |
|
|
|
Thiabendazole |
| Primidone |
|
|
|
Thiacetarsamide |
| Sulfonamides |
|
|
|
Vitamin K (intravenous) |
| Thiacetarsamide |
|
|
|
|

.jpg)
