Спонтанные новообразования в полости черепа у собак поразительно схожи со своими человеческими аналогами, поэтому могут использоваться в качестве крупной модельной системы, позволяющей реалистичнее оценивать новые методы лечения, которые обычно разрабатываются в небольших экспериментах на грызунах. Мы исследовали возможность применения традиционной системы конвекционной доставки (КД) липосомных наночастиц, содержащих ингибитор топоизомеразы СРТ-11, для собак со спонтанно развившимися глиомами. Для лучшей визуализации процесса введения раствора в ткань опухоли путем магнитно-резонансной томографии (МРТ) мы использовали липосомы идентичного состава, содержащие гадотеридол. Распределение инфузионного раствора в опухоли и нормальных тканях мозга оценивали с помощью МРТ в реальном времени. Наиболее значимым фактором, ограничивавшим объем распределения раствора в ткани опухоли, было вытекание инфузионного раствора в желудочки или субарахноидальное пространство. Данные МРТ в реальном времени и гистологического исследования показали, что уменьшение объема опухоли, некроз опухоли и изменение ее фенотипа коррелируют с объемом распределения инфузионного раствора (Vd), зоной введения инфузионного раствора и его проникновением в желудочки/субарахноидальное пространство. Настоящее исследование показывает возможность использования спонтанных глиом у собак в качестве модельной системы для разработки и проверки эффективности новых стратегий лечения новообразований головного мозга у людей.
Данные, полученные при оценке инфузии раствора в крупную спонтанно развившуюся опухоль в реальном времени, могут способствовать более точному прогнозированию и оптимизации параметров инфузии. Вариабельность Vd при разных опухолях дает веские основания предполагать, что методы визуальной диагностики в реальном времени должны стать неотъемлемым компонентом клинического исследования методов КД, чтобы максимально ограничить попадание инфузионного раствора в здоровые ткани и точно оценить клинические исходы.
Ключевые слова: опухоли головного мозга, СРТ-11, конвекционная доставка, магнитно-резонансная томография.
При лечении злокачественных глиом традиционными методами прогноз оценивается как неблагоприятный, что оставалось практически неизменным на протяжении последних 30 лет. Разработано много новых стратегий лечения злокачественных глиом; однако лишь немногие из них продвинулись дальше начальной фазы клинических испытаний. Одной и основных причин невозможности воспроизведения эффектных результатов доклинических исследований является слишком значительные различия между спонтанными крупными инвазивными опухолями у людей и классическими мелкими клональными опухолями у грызунов, получаемыми путем трансплантации чужеродной ткани животных с ослабленным иммунитетом и служащими типичной моделью для доклинических исследований и разработок. Вероятно, что недавно появившиеся трансгенные модели глиомы помогут создать условия, приближенные к практике, по крайней мере на молекулярном уровне;1 показано, что некоторые эксперименты на грызунах с ортотопической трансплантацией позволяют реалистично моделировать клиническую ситуацию, например, статус 1p19q, хирургическое лечение и применение комбинированной химиотерапии. Однако при этом сохраняются значительные ограничения, свойственные экспериментам на грызунах, в особенности связанные с механизмами доставки лекарств и гетерогенности опухоли.
Спонтанные раковые опухоли у домашних собак, в том числе опухоли нервной системы, настолько же разнообразны, как раковые опухоли человека, и имеют значительное сходство со своими человеческими аналогами. Часто определенные виды рака распространены у конкретных пород, в пределах которых существует незначительная генетическая вариабельность. Таким образом, однородность создает идеальные предпосылки для изучения лежащих в основе генетических нарушений. Ряд факторов делает опухоли собак привлекательной моделью для разработки лекарств, как, например, относительно быстрый прогресс раковых опухолей по сравнению с человеческими и возможность длительного лечения (по сравнению с экспериментами на грызунах) «крупных» спонтанных опухолей, характеризующихся как неоднородностью, так и геномной нестабильностью. Все эти факторы в сочетании могут дать быстрый и более реалистичный подход к доклинической оценке новых стратегий лечения, разработанных и испытанных в экспериментах на грызунах.
Частота первичных опухолей головного мозга и центральной нервной системы (ЦНС) у людей составляет приблизительно 6-12 на 100 000 человек-лет, при этом частота обнаружения опухолей головного мозга при вскрытии примерно 2%.9 Хотя истинная частота глиом у собак неизвестна, судя по результатам вскрытий, частота новообразований головного мозга у собак близка к таковой у людей (т. е. приблизительно 3%), при этом на первичные опухоли в полости черепа приходится приблизительно 2%.10 Распространенность новообразований нервной системы в популяции домашних собак в целом также сходна и оценивается как 14,5 на 100 000 животных-лет. Наряду со сходной частотой возникновения, спектр типов опухолей у собак и людей также очень сходен по гистологическим особенностям и картине при визуальном исследовании нервной системы. Хотя молекулярные и цитогенетические свойства первичных опухолей головного мозга собак еще недостаточно изучены, со времени публикации собачьего генома их исследование значительно продвинулось. Уже описаны многие сходные черты опухолей собак и людей, относящиеся к хромосомной нестабильности, профилю генной экспрессии, наличию опухолевых клеток, напоминающих стволовые, экспрессии факторов роста и их рецепторов, например, EGF, PDGF, VEGF, а также других маркеров, часто встречающихся в опухолях человека, например, IL-13Ra2, IGFBP2 и активность теломеразы.
Данные об эффективности стандартных методов лечения при глиомах у собак ограничены, возможно, что между человеческими и собачьими глиомами существуют некоторые значимые различия, аналогично описанным для менингиом.30,32 Однако по мере обнаружения все большего молекулярного сходства спонтанные опухоли собак, имеющие относительно большие размеры и гетерогенную природу, становятся все более привлекательной моделью для переходной (от доклинической к клинической) стадии исследований целевой и нецелевой терапии, поскольку точнее имитируют клиническую ситуацию в медицине.
Конвекционная доставка (КД) лекарственных веществ в головной мозг – многообещающая стратегия лечения, заключающаяся в непосредственной инфузии высококонцентрированных растворов лекарств, при этом общее токсическое действие по существу исключается.33
Однако невозможность на данный момент точно установить объем и распределение инфузионных растворов в реальном времени значительно ограничивает терапевтическую эффективность в каждом конкретном случае и ограничивает наши возможности объективной оценки результата в клинических исследованиях. CPT-11 (иринотекан) – водорастворимое производное мощного противоопухолевого алакалоида камптотецина, действующее как специфический ингибитор топоизомеразы I.34 Показано, что при системном введении это один из самых активных препаратов против различных ксенотрансплантатных опухолей ЦНС.35 На основании этих экспериментальных данных были начаты клинические исследования CPT-11 при различных первичных опухолях головного мозга, в форме монотерапии или в сочетании с другими препаратами. Так как прогноз при традиционной терапии внутричерепных глиом у собак обычно неблагоприятный, мы пришли к выводу, что такие опухоли могут послужить хорошей и приближенной к реальности переходной модельной системой для оценки значимости МРТ в реальном времени во время КД новых терапевтических препаратов в опухоль. Мы пока зали, что КД липосомных наночастиц, содержащих ингибитор топоизомеразы I СРТ-11 и суррогатный маркер гадотеридол, в ткань спонтанно развившихся и не подвергавшихся резекции глиом осуществима на практике и потенциально эффективна. Кроме того, эффективность, определяемая по уменьшению объема опухоли и изменению ее фенотипа, коррелировала с объемом распределения инфузионного раствора (Vd), местом установки канюли и вытеканием инфузионного раствора за пределы опухоли по данным магнитно-резонансной томографии (МРТ) в реальном времени. Эти данные дают основания полагать, что методы визуальной диагностики в реальном времени должны стать неотъемлемым компонентом исследований КД лекарств, и что КД непосредственно в опухоль может стать дополнительной возможностью лечения неоперабельных опухолей. Вероятно, что дальнейшее изучение метода КД при спонтанных глиомах у собак с сопоставлением параметров инфузии с данными визуальной диагностики и гистологического исследования даст ценные данные для оптимизации КД, а также позволит предварительно оценить эффективность и безопасность новых терапевтических средств.
Материалы и методы
Пациенты
Собаки, которым вводили липосомы с СРТ-11 путем КД, были пациентами университетской клиники Ветеринарной школы Университета Калифорнии, Дэвис. Клиническое исследование было рассмотрено и одобрено Комиссией по содержанию и использованию животных (IACUC) Университета Калифорнии, Дэвис, и контрольной комиссией по клиническим исследованиям VMTH. У всех собак были развившиеся спонтанно внутричерепные глиомы, подтвержденные гистологически путем биопсии под контролем стереотаксической КТ. Подходящими кандидатами для лечения считали собак с минимальными неврологическими нарушениями при поступлении и рострально-тенториальным расположением опухоли в мозжечке или таламусе. Всем животным делали полный клинический анализ крови, биохимический анализ сыворотки и анализ спинномозговой жидкости (СМЖ) непосредственно перед процедурой КД, а также при контрольном МРТ через определенное время после инфузий. Кровь отбирали из яремной вены, а СМЖ - из мозжечково-мозговой цистерны (под наркозом). В СМЖ определяли содержание белка и клеток в течение 30 минут после забора. На протяжении исследования состояние животных контролировали путем серии неврологических осмотров и МРТ.
Приготовление липосом
Липо сомы для контроля инфузии с помощью МРТ и доставки СРТ-11 готовили отдельно. Гадотеридол (Gd) был приобретен в готовом виде в форме 0,5 М 10-(2-гидркосипропил)-1,4,7,10-тетраазациклододекан-1,4,7-триуксусной кислоты (Проханс; Bracco Diagnostics, Принстон, Нью-Джерси). Гадолиний, инкапсулированный в липосомах, готовили как описано ранее.37,38 Вкратце: липиды гидратировали в растворе Проханс с последующей 5-кратной экструзией через поликарбонатную мембрану 0,2 мкм, а затем 8-кратной экструзией через поликарбонатную мембрану 0,1 мкм. Неинкапсулированный гадотеридол удаляли путем очистки на колонке для гель-фильтрации Sephadex G-75 и элюирования физиологическим раствором, забуференным ГЭПЭС (pH 7,25). Полученные липосомы с гадолинием, имеющие диаметр от 93,6 до 108 мм по результатам измерения с помощью квазиупругого рассеяния света (анализатор размеров частиц N4Plus, Beckman Coulter, Фуллертон, Луизиана), стерилизовали путем пропускания через шприцевой фильтр с мембраной из полиэфирсульфона (ПЭС) 0,2 мкм. СРТ-11 (подарок от компании PharmaEngine, Inc., Тайбэй, Тайвань) вносили в липосомы, состоящие из 1,2-дистеароил-sn-глицеро-3-фосфохолина, холестерина и 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] (PEG–DSPE) в молярном соотношении 3:2:0,015 вместе с компонентом для удерживания лекарства триэтиламмония-сахарозы октасульфатом (TEA-SOS), как описано ранее.39 CPT-11*HCl инкубировали с TEA-SOS, содержащим липосомы, при 60оС (рН 6,0) в течение 45 минут, а затем охлаждали на льду 15 минут. Неинкапсулированный СРТ-11 удаляли путем гель-фильтрации на колонке Sephadex G75, а липосомы с СРТ-11 концентрировали в клеточном концентраторе с мешалкой и мембраной из регенерированнойю целлюлозы 1 × 105 NMWL (Amicon, Millipore Corp., Биллерика, Массачусетс) и стерилизовали пропусканием через шприцевой фильтр с мембраной 0,2 мм из ПЭС. Концентрацию СРТ-11 определяли путем измерения поглощения образца, переведенного в растворимое состояние, при 375 нм. Окончательный состав содержал СРТ-11 в нанолипосомной форме в концентрации, эквивалентной 45 мг/мл СРТ-11, и гадотеридол в нанолипосомной форме с концентрацией, эквивалентной 2,0 мМоль гадотеридола.
Получение МРТ-снимков
Поперечные Т1- и Т2-взвешенные изображения головного мозга собак получали после фиксации головы животных в стереотаксической рамке. Для получения исходных изображений в режиме градиентного эха с очищением (SPGR) использовали сканер Signa LX 1,5 Т (GE Medical Systems, Ваукеша, Висконсин) с круглой катушкой 5′′; время повтора (TR) = 28 мс, время эхо (TE) = 8 мс, угол поворотов = 408, толщина среза = 1 мм, число возбуждений (NEX) = 3, матрица = 256 × 192, поле зрения = 16 × 16 см. Снимки в режиме SPGR делали непрерывно на протяжении всей инфузии. T2-взвешенные изображения получали до и после инфузий: время повтора = 250 мс, время эхо = 110 мс, длина следа эхо = 29, толщина среза = 2 мм, число возбуждений = 4, матрица 256 × 224, поле зрения = 16 × 16 см. Число срезов варьировало в зависимости от локализации и протяженности зоны инфузии (50 – 70 срезов), а длительность сканирования варьировала от 13 до 15 минут. Стереотаксические координаты участков имплантации определяли с помощью МРТ-снимков. Ростральные/каудальные координаты определяли по линейным (растительное масло) контрольным маркерам, располагавшимся в ушных фиксаторах. Медиальную/латеральную и дорсальную/вентральную координаты определяли непосредственно по костным ориентирам на МРТ-снимках, включая наружный сагиттальный гребень и поверхность черепа.
Стереотаксическая рамка/ инфузия с целью КД
Собак под наркозом располагали в совместимой с МРТ стереотастической рамке, предназначенной для фиксации головы приматов, которую дополнили держателем прикусной пластинки. Компоненты рамки были изготовлены из плексигласа, алюминия или бронзы. Для каждого животного на месте изготавливали зубные слепки из винилполисилоксанового пластичного материала (ExpressTM STD, 3 M ESPE Dental Products, Сент-Пол, Миннесота) и фиксировали голову при помощи прикусной пластинки и ушных фиксаторов (рис. 1).
Система канюли для инфузии состояла из четырех компонентов (рис. 1): (i) цилиндрического основания-проводника диаметром 12 мм (27 отверстий) или 8 мм (6 отверстий) (Plastics One, Inc., Роанок, Виргиния), (ii) канюли для инфузий из плавленого кварца, состоящей из внешней канюли 22G и внутренней канюли 28G, которая была длиннее внешней на 2 мм, образуя уступ, (iii) стерильной тефлоновой трубки для подачи раствора (внутренний диаметр 0,508 мм), содержащей липосомы (Upchurch Scientific, Ок Харбор, Вашингтон) и (iv) нестерильной трубки, содержащей оливковое масло (Upchurch Scientific). Руководствуясь координатами МРТ, каждое основание-проводник устанавливали на стереотаксический манипулятор (David Kopf Instruments, Туюнга, Калифорния), прикрепленный к рамке для головы, и вручную перемещали в требуемую область мозга через трепанационные отверстия в черепе, сделанные после хирургической подготовки и дезинфекции места установки. Основания-проводники фиксировали к черепу с помощью бронзовых винтов и геля уретана-диметакрилата, отверждаемого УФ-облучением (Triad Gelw, Dentsply International Inc., Йорк, Пенсильвания). Все основания-проводники оставляли на месте на весь период лечения с целью повторных инфузий. После инфузий хирургическую рану закрывали над основанием-проводником, которое герметично закрывали пластиковыми завинчивающимися крышками. Всем собакам во время операции вводили антибиотики (цефазолин 22 мг/кг в/в каждые 4 ч) и назначали 2-недельный курс антибиотиков внутрь после операции (цефалексин 22 мг/кг внутрь каждые 12 ч).
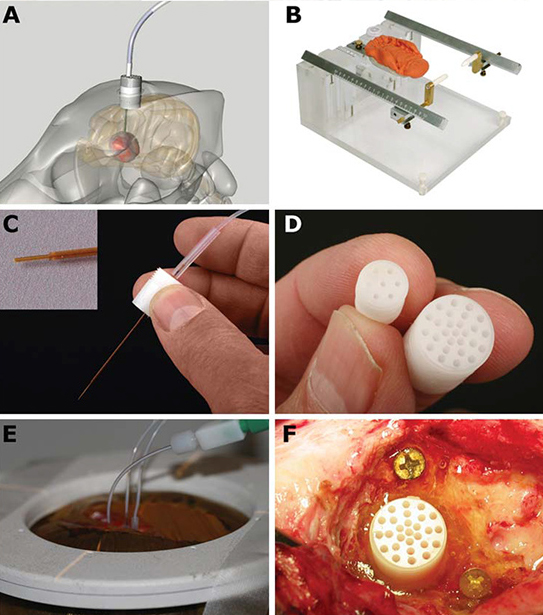 Рис. 1. Экспериментальное оборудование для конвекционной доставки, использовавшееся для собак.
Рис. 1. Экспериментальное оборудование для конвекционной доставки, использовавшееся для собак.
(А) Схематическое изображение имплантируемого основания-проводника.
(В) Совместимая с МРТ рамка для фиксации головы с ушными фиксаторами и прикусной пластинкой.
(С) Канюля для инфузий из плавленого кварца ступенчатой формы для предотвращения обратного тока жидкости, вводящаяся в опухоль через основания-проводники, установленные с помощью стереотаксической системы.
(D) Основание-проводник с множеством отверстий, позволяющих регулировать координаты воздействия на опухоль.
(Е) Одновременная инфузия жидкости, содержащей липосомы, через 3 инфузионные канюли.
(F) Основание-проводник закреплено на месте с помощью быстроотверждаемого уретан-диметакрилата.
КД путем инфузии проводили по описанным ранее техникам. Вкратце: собак помещали в МРТ-сканер; затем вставляли канюлю для инфузии, присоединяли трубки для ввода лекарственного средства и инфузии и закрепляли. Давление для инфузии создавали с помощью шприца объемом 1 мл, заполненного маслом и закрепленном в микроинфузионном насосе (BeeHiveTM, Bioanalytical Systems, Вест-Лафайет, Индиана), установленном за пределами сканера. Инфузию начинали со скорости 0,1 мкл/мин и повышали до 0,2, 0,5, 0,8, 1,0, 1,5, 2,0, 2,5 и максимум 5,0 мкл/мин с интервалом 10 минут. Для каждой процедуры инфузии использовали до 4 отдельных канюль в зависимости от размера опухоли и места установки основания-проводника. Инфузию повторяли в зависимости от роста опухоли (или в случае недостаточной инфузии с последующим недостаточным откликом) по результатам серии МРТ с интервалом 6 - 8 недель.
Количественная оценка объема
Объем опухоли и распределение инфузионного раствора (Vd) в тканях опухоли определяли с помощью программного обеспечения для трехмерного анализа изображений (OsiriX v.3.1, OsiriX Imaging Software, Osirix Foundation, Женева, Швейцария). Вкратце, объемы опухоли определяли по Т2-взвешенным изображениям, а распределение инфузионного раствора – по Т1-взвешенным изображениям в SPGR режиме. Области интереса (ОИ) на отдельных последовательных изображениях определяли вручную, а объемы вычисляли с помощью программы для определения объема.
Патологическое исследование нервной системы
После эутаназии головной мозг погружали в 10% забуференный раствор формалина на 7 дней, готовили поперечные срезы толщиной 3 мм и фотографировали макроскопические изменения цифровым фотоаппаратом. Отдельные ткани обрабатывали обычным способом для заливки в парафин, а затем готовили срезы толщиной 5 мкм и окрашивали гематоксилином и эозином (ГЭ) и люксоловым прочным синим – ГЭ. Отдельные срезы также окрашивали иммуногистохимическими красителями по модифицированной иммунопероксидазной технике без мечения стрептавидином-биотином, с аминоэтилкарбазидом в качестве хромогена, как по существу описано ранее.42 Использовались поли- или моноклональные мышиные антитела со стандартным набором иммунофенотипических маркеров клеток собак, включая CD3, CD18, CD45, CD 79a, а также CD20, CD31, фактор VIII RA, GFAP, каспазу 3, трехкомпонентный белок нейрофиламентов, синаптофизин и Neu-N; разведение антител, предварительная обработка и положительные контроли описаны ранее.42 Прол иферативный индекс опухоли (в %) вычисляли по иммунореактивности к MIB-1. Все глиомы собак, диагностированные по результатам начальной биопсии под контролем КТ и после вскрытия, классифицировали гистологически и определяли тип в соответствии с критериями классификации опухолей ЦНС у людей согласно ВОЗ 2007.43
Результаты
9 собакам с внутричерепными глиомами (1 астроцитома II степени, 3 анапластических астроцитомы, 2 олигодендроглиомы, 3 анапластических олигодендроглиомы) вводили липосомы с СРТ-11/гадотеридолом в форме инфузии. Данные о породе, поле, возрасте собак и параметры инфузии представлены в таблице 1. Общая длительность инфузии варьировала от 135 до 290 минут. Максимальный полный объем инфузии (между 3 катетерами) за одну процедуру составил 2,125 мл.
Объем опухоли/ объемы инфузионных растворов
Для введения инфузионного раствора в опухоль использовали от 1 до 4 канюль (рис. 1), во всех случаях удалось ввести раствор непосредственно в опухоль без резекции. Во всех случаях ход инфузии контролировали с помощью МРТ приблизительно через каждые 15 минут. Инфузии продолжались от 1 до 4 ч, а общий объем инфузионного раствора варьировал от менее 50 мкл до приблизительно 2 мл. У 7 из 8 собак объем опухоли был определен по Т2-взвешенным снимкам правильно. У собаки 3 было выявлено значительное изменение сигнала на Т2-взвешенных снимках после инфузии, что снизило достоверность оценки объема опухоли, поэтому данное животное было исключено из анализа объема и распределения. Протяженность опухоли, определенная путем МРТ, коррелировала с результатами гистологического исследования, сделанного после вскрытия, у всех собак, кроме собаки 3.
Максимальный объем опухолей у собак лежал в диапазоне 1,29–7,13 см3 (среднее 4,0 см3, медиана 3,6 см3, СО 2,3 см3). Объем распределения инфузионного раствора (Vd) и процент контактировавшей с ним ткани опухоли были вычислены по 27 инфузиям. Vd значительно варьировал как от процедуре к процедуре, так и между отдельными катетерами при каждой процедуре. Диапазон распределения инфузионного раствора в ткани опухоли для отдельных процедур составил 0,02 – 90% (среднее 38%, медиана 28%, СО 23%).
Клинический эффект инфузий при опухолях, отвечающих на химиотерапию СРТ-11, оценивавшийся по результатам повторной МРТ и гистологического исследования, субъективно коррелировал с Vd по данным МРТ в реальном времени во время инфузии (рис. 2-4). При недостаточной эффективности инфузии за счет преждевременного вытекания раствора и малого объема распределения уменьшение объема опухоли на снимках было минимальным (рис. 3), в то время как инфузии с большим объемом распределения и охватом большей площади опухоли приводили к очевидному уменьшению ее объема, некрозу и замедлению или прекращению роста.
Вытекание раствора
Самым распространенным ограничением процедуры было вытекание инфузионного раствора в зоны низкого давления, например, желудочки и субарахноидальное пространство (рис. 2, 3 и 6), уменьшавшее объем распределения в тканях опухоли, как описано ранее.44 Кроме того, обнаружено поступление раствора в некротические полости, оставшиеся от предыдущих инфузий, и в соседние нормальные структуры мозга, например, внутреннюю капсулу (рис. 4 и 6). Обратный ток инфузионного раствора через канюлю отмечался редко при условии, что скорость инфузии не превышала 5 мкл/мин. Инфузии со скоростью >5 мкл/мин применялись только в случаях, когда объем распределения переставал увеличиваться в результате вытекания раствора в области низкого давления (рис. 2, 3 и 6). Как только раствор начинал вытекать, увеличение объема распределения почти прекращалось независимо от скорости инфузии.
Таблица 1. Характеристики собак, участвовавших в исследовании
| № пациента |
Порода/пол |
Возраст |
Тип опухоли/ степень злокачественности |
Время выживания (дней)b |
Число инфузий для КД |
Причина смерти |
| 1 |
Джек-рассел-терьер, КС |
9 |
Астроцитома II/IIIa |
+331 |
3 |
Эутаназия (гемангиосаркома)c |
| 2 |
Боксер, К |
8 |
Астроцитома II/IIIa |
+560 |
6 |
Эутаназия (прогрессирование опухоли) |
| 3 |
Французский бульдог, КС |
10 |
Астроцитома II/IIIa |
+363 |
3 |
Эутаназия (прогрессирование опухоли) |
| 4 |
Лабрадор, КК |
10 |
Астроцитома II |
+190 |
3 |
Эутаназия (панкреатит)c |
| 5 |
Бостон-терьер, КК |
6 |
Олигодендрогли-ома II |
+126 |
1 |
Смерть (эпилептический статус)c |
| 6 |
Боксер, КК |
7 |
Олигодендрогли-ома III |
+147 |
2 |
Эутаназия (прогрессирование опухоли) |
| 7 |
Английский бульдог, КК |
5 |
Олигодендрогли-ома III |
+190 |
3 |
Эутаназия (прогрессирование опухоли) |
| 8 |
Лабрадор, КС |
14 |
Олигодендрогли-ома II |
+611 |
3 |
Собака жива |
| 9 |
Бостон-терьер, К |
6 |
Олигодендрогли-ома III |
+181 |
2 |
Собака жива |
К – кобель; КК – кастрированный кобель; КС – кастрированная сука.
a - Степень злокачественности по данным исходной биопсии под контролем КТ; окончательная степень злокачественности, определенная после вскрытия.
b - Время выживания вычисляли с даты постановки диагноза по результатам МРТ.
c - Причина смерти не была связана с прогрессированием опухоли.
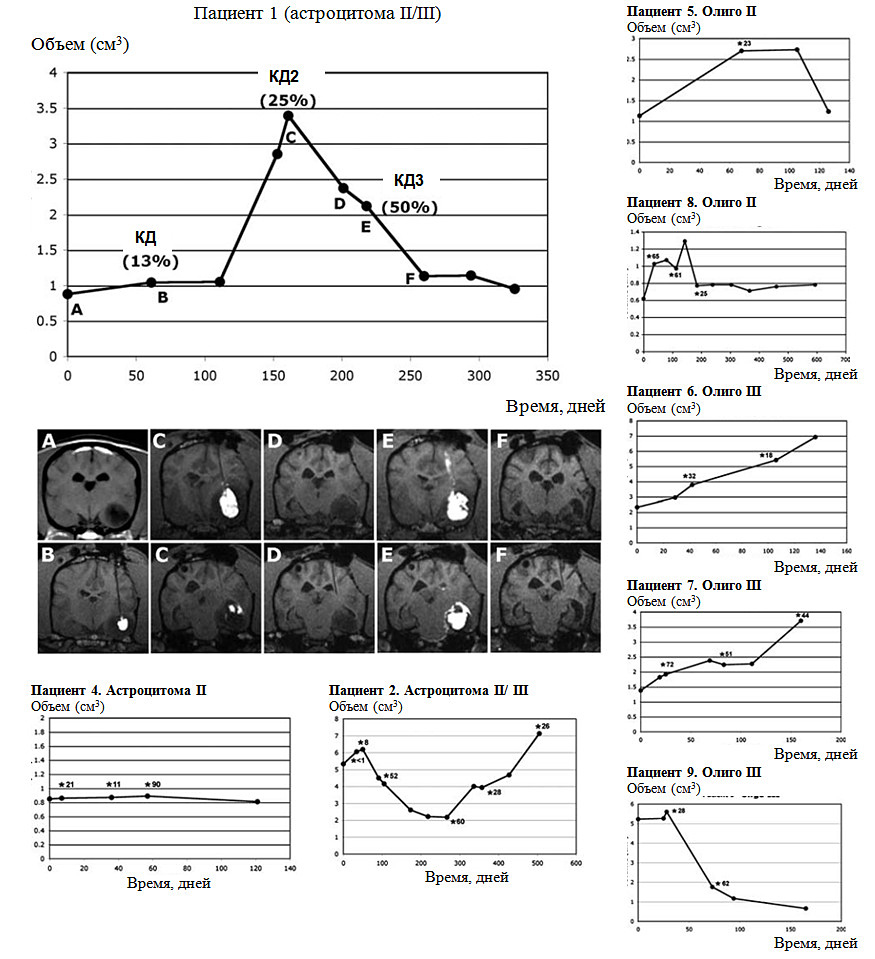
Рис. 2. Объемы опухоли у пациентов после КД липосом, содержащих СРТ-11, в опухоль.
Процедуры КД путем инфузии отмечены звездочкой с указанием процента объема опухоли, подвергшегося воздействию при каждой инфузии. Показаны данные пациента 1 с соответствующими МРТ-снимками. Картина на МРТ-снимках (Т1-взвешенных) коррелирует со временем введения препарата или контроля, представленным на графиках. Контроль инфузии в реальном времени показывает, что правильный выбор места инфузии и объема распределения имеет решающее значение для объективной оценки терапевтической эффективности.
(А) Исходный МРТ-снимок и объем опухоли.
(В) Первая инфузия через одну канюлю, объем распределения 13%, последующее замедление роста опухоли было минимальным.
(С) В связи с быстрым ростом опухоли была проведена вторая инфузия, при которой объем распределения в тканях опухоли составил 25%, после чего объем опухоли уменьшился (D).
(E) Третья инфузия через 3 канюли позволила достичь объема распределения в ткани опухоли 55%. Отмечено резкое уменьшение объема опухоли (F), за которым последовала статическая фаза, продолжавшаяся до эутаназии животного по причинам, не связанным с первичной опухолью. Признаки обратного тока инфузионного раствора (Е, верхний ряд) и вытекания в желудочки и субарахноидальное пространство (Е, нижний ряд) были четко видны на снимках и требовали прекращения инфузии для максимального снижения риска токсичности.
В этом случае, когда опухоль очевидно чувствительна к химиотерапии, повышение объема распределения по данным МРТ в реальном времени сопровождалось более выраженным результатом в форме уменьшения объема опухоли.
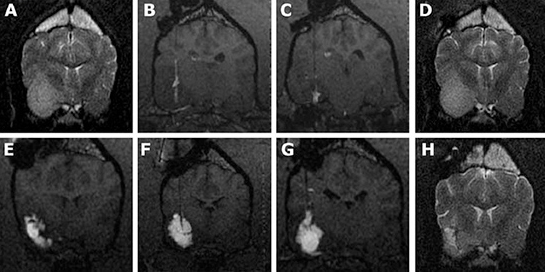 Рис. 3. МРТ-снимки боксера с астроцитомой III степени.
Рис. 3. МРТ-снимки боксера с астроцитомой III степени.
(А).Исходный диагностический МРТ-снимок; новообразование височной/грушевидной доли лучше всего видно на Т2-взвешенных изображениях.
(В и С) Т1-взвешенные изображения в реальном времени, сделанные во время двух инфузий (с двухнедельным интервалом), показывают недостаточный объем распределения в ткани опухоли из-за вытекания раствора в субарахноидальное пространство и боковой желудочек. Из-за недостаточного распределения уменьшение объема опухоли было минимальным (D).
Изменение положения основания-проводника с целью введения раствора в другие участки опухоли позволило добиться большего объема распределения (>50%) при инфузии через 3 канюли (E, F, G, T1-взвешенные изображения).
(H) T2-взвешенное изображение, сделанное через 2 месяца после успешной инфузии; результатом увеличения объема распределения стало уменьшение объема опухоли и меньшее сдавливание соседних тканей (в ткани опухоли присутствует зона размягчения, а извилины на пораженной стороне и латеральный желудочек видны более четко).
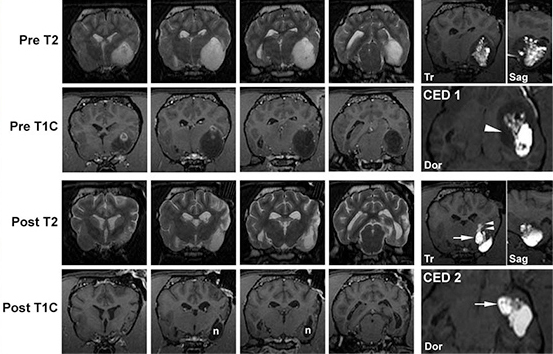 Рис. 4. МРТ-снимки бостон-терьера с олигодендроглиомой III степени.
Рис. 4. МРТ-снимки бостон-терьера с олигодендроглиомой III степени.
При двух инфузиях (КД 1, 2) объем распределения в опухоли составил 28 и 62%, соответственно, что привело к уменьшению объема опухоли на 88% через 5 месяцев после начала лечения. На МРТ-снимках, сделанных после процедуры, видно уменьшение объема опухоли, уменьшение сдавливания окружающих тканей и предполагаемый некроз (n) ткани опухоли. МРТ в реальном времени во время первой инфузии выявило плохое проникновение раствора в медиальные части опухоли (треугольная стрелка). При второй процедуре канюля была специально установлена в эту область, благодаря чему удалось добиться хорошего распределения раствора по медиальной части (стрелки). Из-за слишком поверхностного размещения этой канюли в опухоли в конечном итоге жидкость начала вытекать во внутреннюю капсулу (двойная треугольная стрелка). Контроль инфузии с помощью МРТ в реальном времени позволил выявить это и прекратить инфузию, чтобы снизить возможное токсическое действие. Tr, поперечное изображение; Sag, изображение в сагиттальной плоскости; Dor, изображение в дорсальной плоскости.
Клинический ответ/ изменения на МРТ-снимках
Максимальное процентное уменьшение объема опухоли после терапии составило 88%, при этом в 5 случаях объем опухоли уменьшился на 40% или больше (2 астроцитомы III степени 65% и 72%; 2 олигодендроглиомы II степени 40% и 55%; 1 олигодендроглиома III степени 88%). В одном случае астроцитомы II степени (собака 4) размер опухоли оставался неизменным. У двух собак (собаки 1 и 8) размер опухоли вначале уменьшился, а затем оставался статичным. У собаки 1 рост опухоли отсутствовал на протяжении 2 месяцев, а затем она подверглась эутаназии по не связанной с опухолью причине. Собака 8 жива, роста опухоли не наблюдается на протяжении 14 месяцев. Собака 9 жива через 6 месяцев после постановки диагноза, объем опухоли уменьшился на 88%. В двух случаях анапластической олигодендроглиомы III степени видимого ответа на терапию не отмечено.
Нежелательные явления
Все собаки, кроме собаки 3, хорошо переносили установку канюль и инфузию. По словам владельцев, собаки выглядели спокойнее чем обычно в течение 4 – 5 дней после инфузий, однако в последующем уровень активности восстанавливался. Собака 3 долго выходила из наркоза после первой инфузии, оценка неврологического статуса оставалась сниженной в течение 8 недель после процедуры. МРТ показала диффузную гиперинтенсивную зону в белом и сером веществе со стороны опухоли, характерную для вазогенного и цитотоксического отека. И изменения на МРТ-снимке, и клинические симптомы уменьшились после кортикостероидной терапии (преднизолон 0,5 мг/кг дважды в сутки [рис. 6]). У собаки 8 отмечено легкое ухудшение неврологического статуса в течение 2 недель посте второй процедуры, а также усиление сигнала преимущественно от белого вещества со стороны опухоли на Т2-взвешенных изображениях, однако эти изменения быстро исчезли после кортикостероидной терапии.
СМЖ отбирали последовательно у 8 собак, при этом у 5 обнаружен легкий, преимущественно лимфоцитарный плейоцитоз (от 4 до 158 ядерных клеток/мкл; норма <3/мкл). 7 из 9 собак получали кортикостероиды в противовоспалительных дозах в связи с отеком тканей вокруг опухоли до процедуры, либо в связи с обнаружением признаков отека на МРТ-снимках после процедуры или плейоцитозе СМЖ.
Патологические изменения
Всего при вскрытии было исследовано 7 опухолей мозга, которые были разделены на 2 группы. В первой группе (5 собак) очаги поражения ткани опухоли соответствовали местам введения инфузионного раствора СРТ-11 в опухоль, судя по МРТ-снимкам, сделанным во время инфузии. В ткани этих опухолей (3 астроцитомы III степени, 1 астроцитома II степени, 1 олигодендроглиома II степени) обнаружены кистозные области размягчения и зоны некроза, соответствующие местам введения инфузионного раствора (рис. 2, 3 и 5; таблица 2). К этим зонам размягчения прилегала зона опухолевых клеток, по морфологии и расположению напоминающих тип не подвергавшихся воздействию препарата клеток, присутствующий в трех астроцитомах III степени и олигодендроглиоме II степени (рис. 5). В астроцитомах клетки, дающие реакцию на ГФКБ, располагались гораздо менее плотно, имели более равномерную веретеновидную форму и пролиферативный индекс в 15 раз ниже (1% по сравнению с 12 – 15%), чем в зонах опухоли, не подвергавшихся действию инфузионного раствора. Хотя каждая из этих опухолей была классифицирована как астроцитома II степени по результатам исходной стереотаксической биопсии, во всех опухолях были обнаружены участки значительного размера, не подвергшиеся воздействию и теперь относящиеся к III степени злокачественности. В олигодендроглиоме (собака 5) II степени обнаружена крупная зона кистозного размягчения ткани, также окруженная опухолевыми клетками с измененной морфологией (с положительной реакцией на ГФКБ) и намного меньшим пролиферативным индексом (1% по сравнению с 4%), чем в зонах опухоли, не контактировавших с инфузионным раствором. В астроцитоме II степени (собака 4) была обнаружена маленькая зона кистозного размягчения ткани, окруженная только таким же слоем клеток астроцитомы II степени, как в необработанных участках.
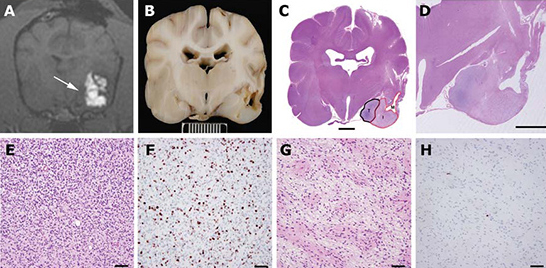 Рис. 5. Результаты вскрытия пациента 1.
Рис. 5. Результаты вскрытия пациента 1.
МРТ в реальном времени во время инфузий и имеющиеся данные вскрытия во всех клинических случаях позволили сопоставить данные гистологического исследования с зонами опухоли, контактировавшими и не контактировавшими с инфузионным раствором, а также нормальными тканями мозга.
(А) Т1-взвешенное изображение, полученное во время последней инфузии, на котором видно недостаточное проникновение инфузионного раствора в ткань опухоли с медиальной стороны (стрелка).
(В) Макроскопический образец ткани, взятый на том же уровне, на котором был сделан МРТ-снимок (длина шкалы = 1 см).
(С) Срез через весь головной мозг (окраска гематоксилином и эозином) с четко видимыми зонами опухоли с участками размягчения (М), подвергавшимися действию инфузионного раствора, участками с измененными клетками (I) и участками, не подвергавшимися действию инфузионного раствора (Т) (длина линии = 500 мкм).
(D) Увеличенное изображение зоны инфузии (окраска гематоксилином и эозином, длина линии 500 мкм). Фенотип клеток опухоли в зонах, подвергавшихся действию инфузионного раствора, изменен (G, гематоксилин и эозин) по сравнению с зонами, куда раствор не попал (E, гематоксилин и эозин).
В доступных для инфузионного раствора участках плотность клеток была ниже, а их фенотип более однороден. Индекс пролиферации MIB-1 в зонах опухоли, контактировавших с инфузионным раствором (Н), составил 1%, а в зонах, не контактировавших с раствором – 15% (E) (E, F, G, H, длина линии 60 мкм).
Таблица 2. Краткие результаты патологического исследования
| № пациента |
Тип опухоли/ степень злокачественности |
Некроз опухоли |
Измененный фенотип |
Снижение MIB-1 (после инфузии) |
Нежелательная реакцияа |
| 1 |
Астроцитома II/III |
++ |
++ |
15% → <1% |
- |
| 2 |
Астроцитома II/III |
++ |
++ |
12% → <1% |
- |
| 3 |
Астроцитома II/III |
+ |
++ |
14% → <1% |
++ |
| 4 |
Астроцитома II |
++ |
- |
- |
- |
| 5 |
Олигодендроглиома II |
++ |
+ |
4% → <1% |
- |
| 6 |
Олигодендроглиома II |
- |
- |
- |
- |
| 7 |
Олигодендроглиома II |
- |
- |
- |
- |
| 8 |
Олигодендроглиома II |
+ |
Н/О |
Н/О |
+ |
| 9 |
Олигодендроглиома II |
++ |
Н/О |
Н/О |
- |
Сокращение: Н/О – не определяли.
аНежелательные реакции определяли как диффузные гиперинтенсивные зоны на Т2-взвешенных изображениях за пределами опухоли или зоны инфузии, отсутствовавшие на снимках до процедуры. Обе нежелательные реакции сопровождались ухудшением неврологического статуса.
У собаки 3 (астроцитома III степени) была отмечена нежелательная реакция на инфузию СРТ-11. В опухоли имелась зона кистозного размягчения, также с большим числом морфологически измененных клеток астроцитомы на периферии и множественными участками активно растущей и агрессивной астроцитомы III степени. Кроме того, за пределами опухоли были обнаружены обширные зоны размягчения тканей головного мозга, ограниченные сморщенными тканями левого полушария и по расположению сопоставимые с изменениями после инфузии, видимыми на МРТ-снимке (рис. 6).
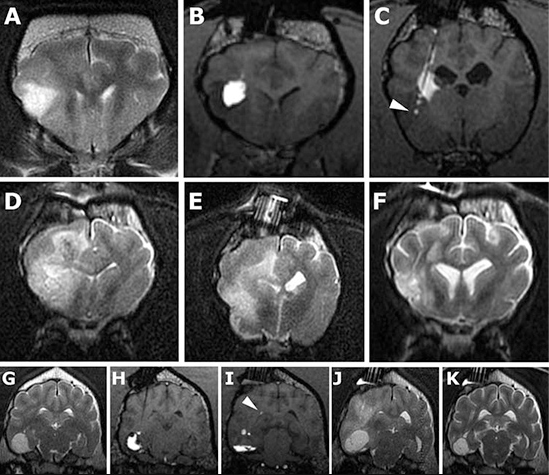 Рис. 6. Нежелательные явления, связанные с инфузиями нанолипосом СРТ-11/ гадотеридола.
Рис. 6. Нежелательные явления, связанные с инфузиями нанолипосом СРТ-11/ гадотеридола.
(Пациент 3, A–F; Пациент 8, G–K.)
(A) Т2-взвешенное МРТ-изображение до инфузии.
(B и C) Путем КД через три канюли раствор вводили в ростральную часть опухоли; однако обратный ток инфузионного раствора через каудальную канюлю привел к его попаданию во внутреннюю капсулу вместо опухоли (треугольная стрелка).
(D и E) T2-взвешенные МРТ-изображения через 8 недель после инфузии; зоны гиперинтенсивности располагаются преимущественно в белом веществе, что сопровождается сдавливанием желудочков и стиранием контуров извилин.
(F) T2-взвешенное изображение через 6 недель после лечения кортикостероидами, гиперинтенсивная область в белом веществе большей частью исчезла.
(G) Т2-взвешенное изображение до инфузии.
Первая (H) и вторая (I) инфузии (T1-взвешенные изображения). При первой инфузии был достигнут достаточный объем распределения в опухоли, в то время как при второй он был ограничен вентральной частью опухоли. В конечном итоге эффективность обеих инфузий снизилась из-за вытекания раствора в желудочек (треугольная стрелка).
(J) Через 4 недели после инфузии наступило ухудшение клинического состояния, сопровождавшееся появлением гиперинтенсивной зоны на Т2-взвешенных изображениях, преимущественно в белом веществе, а также увеличением объема опухоли.
(K) Через 4 недели после кортикостероидной терапии и быстрого разрешения клинических симптомов области гиперинтенсивности на Т2-взвешенных изображениях исчезли, сдавливание окружающих тканей отсутствует, а объем опухоли уменьшился.
Во второй группе из двух олигодендроглиом высокой степени злокачественности (III) не было обнаружено очевидных макро- или микроскопических изменений, соответствующих зонам воздействия инфузионного раствора.
Так как во всех опухолях, как и в окружающих тканях, воспалительная реакция почти отсутствовала, можно полагать, что КД безопасна и липосомы с СРТ-11/Gd не обладают каким-либо вредным токсическим действием, кроме некроза опухоли, обусловленного действием препарата.
Обсуждение и литература
Показано, что непосредственная доставка СРТ-11 и его включение в липосомы снижает местную токсичность и позволяет создать гораздо большие концентрации препарата в месте воздействия по сравнению с системным введением или доставкой свободного препарата.39,45 Эффективность липосомных ингибиторов топоизомеразы, введенных в глиому путем КД в экспериментах на грызунах, описана ранее39,45–47 и согласуется с нашими данными, полученными с помощью одновременной инфузии липосом, содержащих гадолиний в качестве суррогатного маркера, для контроля процесса инфузии.37,48 Кроме того, ранее мы показали пренебрежимо малую частоту клинических и гистологических неблагоприятных явлений после экспериментальной КД липосом, содержащих СРТ-11 в сочетании с гадотеридолом, у здоровых собак,40 а результаты настоящего исследования дают основания полагать, что это относится и к собакам с внутричерепными глиомами. Хотя у большинства животных после инфузии был обнаружен легкий лимфоцитарный плейоцитоз в СМЖ, признаки гистологических или видимых на МРТ-снимках изменений, характерных для нежелательных реакций на инфузию, имелись лишь у двух животных. У обоих животных отмечено ухудшение неврологического статуса, и у обоих быстро наступило улучшение после применения кортикостероидов (рис. 5, табл. 2); однако у животного с наиболее серьезным поражением (собака 3) отмечена выраженная атрофия/размягчение как серого, так и белого вещества. В то время как у этой собаки значительный объем инфузионной жидкости проник в здоровые ткани вокруг опухоли, у второй собаки (собака 8) зоны гиперинтенсивности на Т2-взвешенных изображениях после инфузии были по существу ограничены объемом опухоли, а проникновение инфузионного раствора в окружающие ткани у других животных не сопровождалось видимыми нежелательными явлениями. Вероятность нежелательных явлений из-за случайного попадания липосом в нормальную ткань мозга или СМЖ была сведена к минимуму, поскольку МРТ в реальном времени позволяла прекратить инфузию, изменить ее скорость и/или изменить положение канюли в случае вытекания раствора, его проникновения в нормальные области мозга или прекращении роста объема распределения во время инфузии.
Хотя оценка терапевтической эффективности не была запланированной конечной точкой исследования, очевидно, что введение липосом с СРТ-11 в спонтанно развившиеся опухоли было эффективным, а результаты указывали на предполагаемый механизм действия. Естественная биология спонтанных глиом у собак, как и ответ на традиционные методы лечения, например, лучевую и химиотерапию, недостаточно изучены. Конечной точкой для большинства животных явилась эутаназия, а не общее время выживания, а опубликованные данные о «выживании» при любом лечении варьируют от нескольких дней до нескольких месяцев. Таким образом, эффективность непосредственной инфузии липосом с СРТ-11 в опухоль можно оценить только субъективно в каждом случае на основании результатов МРТ, показывающих уменьшение или отсутствие роста опухоли, или гистологического исследования после эутаназии или смерти. Показано, что инкапсуляция в липосомы улучшает фармакокинетические свойства и длительность пребывания СРТ-11 в тканях, достигающую, по данным экспериментов с грызунами, 2 месяцев после однократного введения путем КД. С этими экспериментальными данными согласуется сохранение эффекта от многократных инфузий в течение нескольких недель, о чем свидетельствовали результаты серии МРТ (рис. 2).
Пять опухолей уменьшились в объеме на 40 – 88%, а у одной собаки с астроцитомой II степени (собака 4) размер опухоли оставался стабильным (рис. 2). Небольшая зона размягчения в опухоли, вероятно, была обусловлена увеличением полости, оставшейся после биопсии под контролем КТ, так как во время лечения было отмечено скопление инфузионного раствора в этой области. Размягчение в результате токсического действия инфузии на нейропиль было сочтено менее вероятным, поскольку такой эффект отсутствовал в остальных случаях, а также в предыдущих экспериментах на собаках.40 Две опухоли, обе представлявшие собой анапластические олигодендроглиомы, характеризовались быстрым ростом и не давали видимого ответа на лечение, судя по результатам МРТ и гистологического исследования. Важно, что отсутствие ответа на лечение в этих случаях наблюдалось на фоне успешных инфузий препарата в ткань опухоли, доказанных МРТ в реальном времени (рис. 2). Процент ткани опухоли, контактировавший с инфузионным раствором, по результатам МРТ варьировал от 32 до 72% - в прочих случаях при таком проценте наблюдался очевидный положительный результат. Таким образом, можно полагать, что в этих случаях имела место истинная неэффективность лекарственного препарата, а не системы доставки. В противоположность этому, отсутствие ответа на лечение у собаки 2 (астроцитома III степени) после первых двух инфузий было очевидно связано с недостаточным объемом распределения в результате вытекания раствора, поэтому воздействию подверглось только 10% ткани опухоли (рис. 2 и 3). Последующая инфузия липосом с СРТ-11, при которой воздействию подверглось >50% ткани опухоли, привела к заметному уменьшению ее объема. Сходные результаты получены с пациентом 1 (астроцитома III степени), когда инфузионный раствор достиг примерно 10% ткани опухоли и клинический эффект был слабым по сравнению с последующими инфузиями, при которых было обработано 25% объема опухоли или больше (рис. 2). Хотя число собак в исследовании было малым и фенотип опухоли варьировал, результаты очевидно доказывают решающее значение визуального исследования в реальном времени для определения объема распределения инфузионного раствора и последующей оценки терапевтической эффективности новых препаратов, доставляемых методом КД.
Механизм снижения чувствительности и отсутствия ответа у двух собак с анапластическими олигодендроглиомами неясен. CPT-11, (7-этил-10-(4-[1-пиперидин]-1-пиперидин) карбонилоксикамптотецин) – водорастворимое производное мощного алкалоидного противоопухолевого средства камптотецина, действующее как специфический ингибитор топоизомеразы I. СРТ-11 превращается в более активный метаболит, SN-38 (7-этил-10-гидроксикамптотецин) под действием карбоксилэстеразы, преимущественно в печени и сыворотке. Точный вклад SN-38 в противоопухолевое действие СРТ-11 в сравнении с иринотекана гидрохлоридом неизвестен, как и его системный метаболизм. Некоторые данные дают основания полагать, что активация иринотекана в тканях опухоли или нервной ткани настолько же важна, как системная активация/ активация в печени, что имеет большое знчение при инфузии непосредственно в опухоль. Одним из примеров наибольшего уменьшения объема опухоли (~90%) после терапии является третья анапластическая олигодендроглиома; это позволяет предположить (что неудивительно), что факторы, определяющие терапевтическую эффективность, варьируют от опухоли к опухоли, даже если они сходны по гистологическому типу и степени злокачественности. Дальнейшее исследование прочих факторов, например, экспрессии карбоксилэстеразы и топоизомеразы в каждой опухоли после инфузии, может дать больше информации о чувствительности при условии, что достаточное воздействие инфузионного раствора подтверждено МРТ во время инфузии.
Основным преимуществом этого исследования собак со спонтанно развившимися опухолями является доступность результатов вскрытия (для всех не выживших животных в исследовании) и, следовательно, возможность определения корреляции данных, которые часто недоступны в клинических исследованиях на людях. При гистологическом исследовании было обнаружено два основных типа реакции опухоли: некроз и изменение фенотипа клеток. Гистологические изменения, обнаруженные после вскрытия, тесно коррелировали с результатами МРТ во время инфузии, что согласуется с прогностической ценностью визуальной диагностики в реальном времени для оценки клинического ответа. При сопоставлении МРТ-снимков, сделанных во время инфузии, и гистологических срезов были выявлены зоны некроза опухоли и/или изменения фенотипа в областях, подвергшихся действию инфузионного раствора, при этом оставшаяся/ новая ткань опухоли за пределами зон, контактировавших с инфузионным раствором, имела более агрессивный фенотип (рис. 5). Изменение фенотипа опухоли обнаружено при вскрытии 4 из 5 животных с уменьшением или прекращением роста опухоли. Изменение характеризовалось появлением свойств, присущих более доброкачественным и менее анапластическим опухолям, а также снижением пролиферативного индекса MIB-1 (рис. 5; табл. 2). Механизм такого изменения фенотипа после воздействия СРТ-11 неясен, но может заключаться в избирательном воздействии на более активно пролиферирующие клетки, в связи с чем в остаточной популяции сохраняются только дифференцированные клетки. Авторы также наблюдали подобное измерение морфологии опухоли после КД липосом с СРТ-11 в экспериментально индуцированные опухоли грызунов в экспериментах с ортотопической трансплантацией клеточной линии собачьей глиомы. Наличие по существу не делящейся, но очевидно жизнеспособной опухолевой ткани после лечения имеет важные последствия как для прогноза, так и для оценки эффективности, измеряемой просто по уменьшению объема опухоли. Обычная МРТ не позволяет различить исходную опухоль и опухоль с измененным фенотипом, таким образом, для определения такой измененной части опухоли могут потребоваться дополнительные визуальные методы, например, получение диффузионно-взвешенных изображений и спектроскопия.
Итак, мы показали, что спонтанные глиомы собак могут служить хорошей моделью крупных спонтанных опухолей для исследования новых методов доставки лекарств, а также новых стратегий лечения новообразований в полости черепа. Можно надеяться, что ретроспективный анализ параметров МРТ и параметры инфузии в этом исследовании, приближенном к клинической ситуации, поможет оптимизировать параметры установки канюль и инфузии. КД химиотерапевтического препарата (липосом с СРТ-11) непосредственно внутрь спонтанно развившейся глиомы мозга большого объема осуществима на практике и хорошо переносится. Судя по наблюдаемому ответу на терапию у собак, введение липосом с СРТ-11 непосредственно в опухоль следует рассматривать в качестве возможного метода лечения, особенно при неоперабельных или рецидивирующих новообразованиях. Как и в настоящем исследовании собак со спонтанными глиомами, в будущих клинических исследованиях на больных глиомой людях решающее значение для оценки и оптимизации КД любых лекарств будет иметь возможность точной оценки хода инфузии в реальном времени. Кроме оценки параметров КД в присутствии соответствующих механизмов и в биологическом окружении, приближенном к практике, исследование на собаках позволяет реалистично оценить возможные нежелательные явления, связанные с инфузией, системой доставки, препаратом и суррогатным маркером у крупных иммунокомпетентных млекопитающих с активным патологическим процессом в полости черепа.
Заявление о конфликте интересов
D.B.K., C.O.N. и D.C.D. владеют акциями или опционом на покупку акций Merrimack Pharmaceuticals, компании, занимающейся разработкой этих новых лекарственных форм. D.B.K. ранее был вице-президентом по фармацевтическим исследованиям и разработкам Hermes Biosciences, компанией, занимающейся разработкой продукта, которая недавно слилась с Merrimack Pharmaceuticals. D.B.K. и D.C.P. являются изобретателями и авторами патентной заявки на высокостабильный состав нанолипосом СРТ-11, описанный в данной рукописи. D.C.P. занимает должность старшего директора по научной работе в компании Merrimack Pharmaceuticals. J.W.P. – член правления, специалист компании Hermes Biosciences, Inc., также владеющий акционерной долей этой компании. Университету Калифорнии – Сан-Франциско принадлежит патент, связанный с этой работой.
Финансирование
Данная работа проведена при поддержке Национального Института здравоохранения [1PO1 CA-118816-0102 и P50 CA097257] и фонда Paul C. and Borghild T. Petersen.
Литература:
1. Fomchenko EI, Holland EC. Mouse models of brain tumors and their applications in preclinical trials. Clin Cancer Res. 2006;12:5288–5297.
2. Branle F, Lefranc F,Camby I, et al. Evaluation of the efficiencyof chemotherapy in in vivo orthotopic models of human glioma cells with and without
1p19q deletions and in C6 rat orthotopic allografts serving for the evaluation of surgery combined with chemotherapy. Cancer. 2002;95:641–655.
3. Vail DM, MacEwen EG. Spontaneously occurring tumors of companion animals as models for human cancer. Cancer Invest. 2000;18:781–792.
4. Koestner A, Bilzer T, Fatzer R, Schulman FY, Summers BA, Van Winkle TJ. Histological Classification of Tumors of the Nervous System of Domestic Animals. 2nd ed, vol. 5. Washington, D.C: The Armed Forces Institute of Pathology; 1999.
5. Paoloni M, Khanna C. Translation of new cancer treatments from pet dogs to humans. Nat Rev Cancer. 2008;8:147–156.
6. Kimmelman J, Nalbantoglu J. Faithful companions: a proposal for neurooncology trials in pet dogs. Cancer Res. 2007;67:4541–4544.
7. Surawicz TS, McCarthy BJ, Kupelian V, Jukich PJ, Bruner JM, Davis FG. Descriptive epidemiology of primary brain and CNS tumors: results from the Central Brain Tumor Registry of the United States, 1990–1994. Neuro Oncol. 1999;1:14–25.
8. McKinney PA. Brain tumours: incidence, survival, and aetiology. J Neurol Neurosurg Psychiatry. 2004;75(suppl 2):ii12–ii17.
9. Klotz M. Incidence of brain tumors in patients hospitalized for chronic mental disorders. Psychiatr Q. 1957;31:669–680.
10. McGrath JT. Intracranial pathology of the dog. Acta Neuropathol (Berl). 1962;1(suppl I):3–4.
11. Schneider R. General considerations. In: Moulton, JE ed. Tumors in Domestic Animals. 2nd ed. Berkley: University of California Press; 1978:1–15.
12. PriesterWA, McKay FW. The occurrence of tumors in domestic animals. In: Ziegler, JL ed. National Cancer Institute Monograph. Bethseda, MD: U.S. Department of Health and Human Services; 1980:1–210.
13. Candolfi M, Curtin JF, Nichols WS, et al. Intracranial glioblastoma models in preclinical neuro-oncology: neuropathological characterization and tumor progression. J Neurooncol. 2007;85:133–148.
14. Summers BA, Cummings JF, de Lahunta A. Tumors of the Central Nervous System. Veterinary Neuropathology St Louis: Mosby; 1995:351–401.
15. Vandevelde M, Fankhauser R, Luginbu¨ hl H. Immunocytochemical studies in canine neuroectodermal brain tumors. Acta Neuropathol (Berl). 1985;66:111 116.
16. Sturges BK, Dickinson PJ, Bollen AW, et al. Magnetic resonance imaging and histological classification of intracranial meningiomas in 112 dogs. J Vet Intern Med. 2008;22:586–595.
17. Stoica G, Kim HT, Hall DG, Coates JR. Morphology, immunohistochemistry, and genetic alterations in dog astrocytomas. Vet Pathol. 2004;41:10–19.
18. Westworth DR, Dickinson PJ, Vernau W, et al. Choroid plexus tumors in 56 dogs (1985–2007). J Vet Intern Med. 2008;22:1157–1165.
19. Snyder JM, Shofer FS, Van Winkle TJ, Massicotte C. Canine intracranial primary neoplasia: 173 cases (1986–2003). J Vet Intern Med. 2006;20:669–675.
20. Thomas WB, Wheeler SJ, Robert K, Kornegay JN. Magnetic resonance imaging features of primary brain tumors in dogs. Vet Radiol Ultrasound. 1996;37:20–27.
21. Kraft SL, Gavin PR, DeHaan C, Moore M, Wendling LR, Leathers CW. Retrospective review of 50 canine intracranial tumors evaluated by magnetic resonance imaging. J Vet Intern Med. 1997;11:218–225.
22. Lipsitz D, Higgins RJ, Kortz GD, Dickinson PJ, Bollen AW, LeCouteur RA. Glioblastoma multiforme: clinical findings, magnetic resonance imaging and pathology in 5 dogs. Vet Pathol. 2003;40:659–669.
23. Dickinson PJ, Roberts BN, Higgins RJ, et al. Expression of receptor tyrosine kinases VEGFR-1 (FLT-1), VEGFR-2 (KDR), EGFR-1, PDGFRa and c-Met in canine primary brain tumors. Vet Comp Oncol. 2006;4:132–140.
24. Dickinson PJ, Sturges BK, Higgins RJ, et al. Vascular endothelial growth factor mRNA expression and peritumoral edema in canine primary central nervous system tumors. Vet Pathol. 2008;45:131–139.
25. Debinski W, Gibo DM, Wykosky J, Stanton C, Rossmeisl J, Robertson J. Canine gliomas over-express IL-13Ralpha2, EphA2 and Fra-1 in common with human high-grade astrocytomas. Neuro Oncol. 2007;9:535.
26. Stoica G, Lungu G, Stoica H, Waghela S, Levine J, Smith R, 3rd. Identification of cancer stem cells in dog glioblastoma. Vet Pathol. 2009;
27. Thomson SA, Kennerly E, Olby N, et al. Microarray analysis of differentially expressed genes of primary tumors in the canine central nervous system. Vet Pathol. 2005;42:550–558.
28. Platt SR, Scase TJ, Adams V, et al. Vascular endothelial growth factor expression in canine intracranial meningiomas and association with patient survival. J Vet Intern Med. 2006;20:663–668.
29. Long S, Argyle DJ, Nixon C, et al. Telomerase reverse transcriptase (TERT) expression and proliferation in canine brain tumours. Neuropathol Appl Neurobiol. 2006;32:662–673.
30. Thomas R, Duke SE, Wang HJ, et al. 'Putting our heads together': insights into genomic conservation between human and canine intracranial tumors. J Neurooncol. 2009;94:333–349.
31. Higgins RJ, Dickinson PJ, Lecouteur RA, et al. Spontaneous canine gliomas: overexpression of EGFR, PDGFRalpha and IGFBP2 demonstrated by tissue microarray immunophenotyping [published online ahead of print December 5, 2009]. J Neurooncol. 2009.
32. Dickinson PJ, Surace EI, Cambell M, et al. Expression of the tumor suppressor genes NF2, 4.1B, and TSLC1 in canine meningiomas. Vet Pathol. 2009;46:884–892.
33. Debinski W, Tatter SB. Convection-enhanced delivery for the treatment of brain tumors. Expert Rev Neurother. 2009;9:1519–1527.
34. Potmesil M. Camptothecins: from bench research to hospital wards. Cancer Res. 1994;54:1431–1439.
35. Hare CB, Elion GB, Houghton PJ, et al. Therapeutic efficacy of the topoisomerase I inhibitor 7–ethyl-10-(4-[1-piperidino]-1-piperidino)-carbonyloxy-camptothecin against pediatric and adult central nervous system tumor xenografts. Cancer Chemother Pharmacol. 1997;39:187–191.
36. Feun L, Savaraj N. Topoisomerase I inhibitors for the treatment of brain tumors. Expert Rev Anticancer Ther. 2008;8:707–716.
37. Saito R, Krauze MT, Bringas JR, et al. Gadolinium-loaded liposomes allow for real-time magnetic resonance imaging of convection-enhanced delivery in the primate brain. Exp Neurol. 2005;196:381–389.
38. Krauze MT, McKnight TR, Yamashita Y, et al. Real-time visualization and characterization of liposomal delivery into the monkey brain by magnetic resonance imaging. Brain Res Brain Res Protoc. 2005;16:20–26.
39. Noble CO, Krauze MT, Drummond DC, et al. Novel nanoliposomal CPT-11 infused by convection-enhanced delivery in intracranial tumors: pharmacology and efficacy. Cancer Res. 2006;66: 2801–2806.
40. Dickinson PJ, LeCouteur RA, Higgins RJ, et al. Canine model of convection-enhanced delivery of liposomes containing CPT-11 monitored with real-time magnetic resonance imaging: laboratory investigation. J Neurosurg. 2008;108:989–998.
41. Bankiewicz KS, Eberling JL, Kohutnicka M, et al. Convection-enhanced delivery of AAV vector in parkinsonian monkeys; in vivo detection of gene expression and restoration of dopaminergic function using pro-drug approach. Exp Neurol. 2000;164:2–14.
42. Higgins RJ, LeCouteur RA, Vernau KM, Sturges BK, Obradovich JE, Bollen AW. Granular cell tumor of the canine central nervous system: two cases. Vet Pathol. 2001;38:620–627.
43. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK. WHO classification of tumors of the central nervous system. 4th ed. Geneva: WHO Press; 2007.
44. Varenika V, Dickinson P, Bringas J, et al. Detection of infusate leakage in the brain using real-time imaging of convection-enhanced delivery. J Neurosurg. 2008;109:874–880.
45. Krauze MT, Noble CO, Kawaguchi T, et al. Convection-enhanced delivery of nanoliposomal CPT-11 (irinotecan) and PEGylated liposomal doxorubicin (Doxil) in rodent intracranial brain tumor xenografts. Neuro Oncol. 2007;9:393–403.
46. Saito R, Krauze MT, Noble CO, et al. Convection-enhanced delivery of Ls-TPT enables an effective, continuous, low-dose chemotherapy against malignant glioma xenograft model. Neuro-oncology. 2006;8: 205–214.
47. Yamashita Y, Krauze MT, Kawaguchi T, et al. Convection-enhanced delivery of a topoisomerase I inhibitor (nanoliposomal topotecan)
and a topoisomerase II inhibitor (pegylated liposomal doxorubicin) in intracranial brain tumor xenografts. Neuro-oncology. 2007; 9:20–28.
48. Saito R, Bringas JR, McKnight TR, et al. Distribution of liposomes into brain and rat brain tumor models by convection-enhanced delivery monitored with magnetic resonance imaging. Cancer Res. 2004;64: 2572–2579.
49. Kaneda N, Nagata H, Furuta T, Yokokura T. Metabolism and pharmacokinetics of the camptothecin analogue CPT-11 in the mouse. Cancer Res. 1990;50:1715–1720.
50. Atsumi R, Okazaki O, Hakusui H. Metabolism of irinotecan to SN-38 in a tissue-isolated tumor model. Biol Pharm Bull. 1995;18:1024–1026.
51. Guichard S, Terret C, Hennebelle I, et al. CPT-11 converting carboxylesterase and topoisomerase activities in tumour and normal colon and liver tissues. Br J Cancer. 1999;80:364–370.
52. Kawato Y, Furuta T, Aonuma M, Yasuoka M, Yokokura T, Matsumoto K. Antitumor activity of a camptothecin derivative, CPT-11, against human tumor xenografts in nude mice. Cancer Chemother Pharmacol. 1991;28:192–198.
53. Ohtsuka K, Inoue S, Kameyama M, et al. Intracellular conversion of irinotecan to its active form, SN-38, by native carboxylesterase in human non-small cell lung cancer. Lung Cancer. 2003;41:187–198.
54. Nagai S, Yamauchi M, Andoh T, et al. Establishment and characterization of human gastric and colonic xenograft lines resistant to CPT-11 (a new derivative of camptothecin). J Surg Oncol. 1995;59:116–124.
55. Niimi S, Nakagawa K, Sugimoto Y, et al. Mechanism of cross-resistance to a camptothecin analogue (CPT-11) in a human ovarian cancer cell line selected by cisplatin. Cancer Res. 1992;52:328–333.
56. Hu ZP, Yang XX, Chen X, Chan E, Duan W, Zhou SF. Simultaneous determination of irinotecan (CPT-11) and SN-38 in tissue culture media and cancer cells by high performance liquid chromatography: application to cellular metabolism and accumulation studies. J Chromatogr B Analyt Technol Biomed Life Sci. 2007;850:575–580.
57. Sanghani SP, Quinney SK, Fredenburg TB, et al. Carboxylesterases expressed in human colon tumor tissue and their role in CPT-11 hydrolysis. Clin Cancer Res. 2003;9:4983–4991.
58. Zhang W, Xu G, McLeod HL. Comprehensive evaluation of carboxylesterase-2 expression in normal human tissues using tissue array analysis. Appl Immunohistochem Mol Morphol. 2002;10: 374–380.
59. Yamada T, Hosokawa M, Satoh T, et al. Immunohistochemistry with an antibody to human liver carboxylesterase in human brain tissues. Brain Res. 1994;658:163–167.
60. Furihata T, Hosokawa M, Satoh T, Chiba K. Synergistic role of specificity proteins and upstream stimulatory factor 1 in transactivation of the mouse carboxylesterase 2/microsomal acylcarnitine hydrolase gene promoter. Biochem J. 2004;384:101–110.

 Рис. 1. Экспериментальное оборудование для конвекционной доставки, использовавшееся для собак.
Рис. 1. Экспериментальное оборудование для конвекционной доставки, использовавшееся для собак.
 Рис. 3. МРТ-снимки боксера с астроцитомой III степени.
Рис. 3. МРТ-снимки боксера с астроцитомой III степени. Рис. 4. МРТ-снимки бостон-терьера с олигодендроглиомой III степени.
Рис. 4. МРТ-снимки бостон-терьера с олигодендроглиомой III степени. Рис. 5. Результаты вскрытия пациента 1.
Рис. 5. Результаты вскрытия пациента 1. Рис. 6. Нежелательные явления, связанные с инфузиями нанолипосом СРТ-11/ гадотеридола.
Рис. 6. Нежелательные явления, связанные с инфузиями нанолипосом СРТ-11/ гадотеридола.