Катя Мариони - Генри (KatiaMarioni-Henry), dvm, mrcvs, PhD
В последние годы наши знания о заболеваниях спинного мозга у кошек усовершенствовались благодаря исследованиям распространенности таких заболеваний, а также гистологических особенностей и магнитно-резонансной томографии (МРТ)1–4. Однако диагностика и лечение некоторых заболеваний спинного мозга, таких как инфекционный перитонит кошек (ИПК; FIP) и лимфосаркома спинного мозга, по-прежнему остается сложной задачей. Данная статья написана с целью обзора последних публикаций, описывающих самые распространенные заболевания кошек, поражающие спинной мозг, а также чтобы сделать некоторые общие выводы, которые будут полезны при формулировке диагноза и прогноза для кошек с поражением спинного мозга. В частности, результаты посмертного исследования 205 кошек с заболеваниями спинного мозга,1 проведенного в Университете Пенсильвании, сравниваются с данными других ретроспективных исследований заболеваний спинного мозга в разных популяциях кошек с помощью разных критериев оценки. В популяции из 205 кошек с гистологически подтвержденным заболеванием спинного мозга наиболее распространенными были воспалительные/инфекционные заболевания (32% кошек), за которыми следовали опухоли (27%), травмы (14%), врожденные или наследственные заболевания (11%), сосудистые заболевания (9%), дегенеративные заболевания (6%) и нарушения метаболизма/питания (1%).1 Ниже обсуждается каждая из этих категорий.
Воспалительные/Инфекционные заболевания
Согласно двум недавним ретроспективным исследованиям, воспалительные/инфекционные заболевания были самым распространенным типом заболеваний спинного мозга у кошек.1,3 Инфекционный перитонит кошек (ИПК) оказался самым распространенным воспалительным/инфекционным заболеванием (51%) среди 205 кошек из Северной Америки с гистологически подтвержденным поражением спинного мозга.1 Эти результаты согласуются с данными, полученными в популяции 286 английских кошек с заболеванием центральной нервной системы (ЦНС), подтвержденным при вскрытии, в которой более чем у 50% кошек с воспалительным заболеванием был обнаружен инфекционный перитонит.3 Прочие воспалительные/инфекционные заболевания, описанные в порядке снижения частоты, включали: бактериальный миелит (16%), криптококкоз (9%), неизвестное воспалительное/инфекционное заболевание (8%), токсоплазмоз (6%), эозинофильный менингомиелит (5%) и идиопатический полиомиелит (5%).1
Инфекционный перитонит кошек – смертельное заболевание, вызываемое вирусом ИПК – высоковирулентным коронавирусом, индуцирующим иммуноопосредованный прогрессирующий полисерозит (влажная форма) и гнойно-гранулематозное воспаление (сухая форма).5 Неврологические симптомы обычно наблюдаются при сухой или гнойно-гранулематозной форме ИПК, а поражение глаз и/или ЦНС встречается менее чем у 9% кошек с влажной формой и у 60% кошек с сухой формой.6 Неврологические симптомы часто множественные, к распространенным клиническим признакам относятся атаксия, угнетенное ментальное состояние, патологический нистагм, тетрапарез/тетраплегия, наклон головы и судороги.6–8 Большинство смертей от ИПК происходит в возрасте от 3 до 16 месяцев.9 К прочим нарушениям спинного мозга у кошек, приводящим к смерти в возрасте до 2 лет, относятся болезни накопления, бактериальный миелит и травма; однако их частота у молодых кошек ниже, чем ИПК.1
Гистологические изменения ЦНС сосредоточены в мозговых оболочках, сосудистом сплетении и эпендиме, распространяясь под мозговые оболочки и в паренхиму.10 Часто обнаруживаются поражения задних и вентральных частей головного мозга.9 В спинном мозге чаще всего поражается шейный отдел; очаги, обусловленные ИПК, присутствовали в шейных сегментах 93% кошек с поражением спинного мозга (рис. 1).1
Диагностировать неврологическую форму ИПК прижизненно сложно. При наличии выпота положительный результат иммунофлюоресцентного окрашивания макрофагов подтверждает диагноз; однако при сухой форме ИПК поставить окончательный диагноз с помощью иммуногистохимического исследования невозможно, если клинические признаки ограничены ЦНС.10,11 У кошек с инфекционным перитонитом могут быть некоторые неспецифические гематологические отклонения, например лейкоцитоз, лимфопения, нерегенеративная анемия и повышение общего белка в сыворотке за счет гиперглобулинемии (наблюдается примерно у 70% кошек с сухой формой).11 Соотношение альбумина/глобулина менее 0,6 – диагностический показатель воспалительного процесса,12 а воспалительные процессы чаще всего связаны с ИПК.
МРТ и компьютерная томография (КТ) головного мозга кошек с неврологической формой ИПК часто показывает гидроцефалию, кроме того, сообщается об усилении сигнала от тканей вокруг желудочков и сирингогидромиелии шейного отдела при МРТ кошек с подозрением на поражение ЦНС вследствие ИПК (см. рис. 1).13–15 Анализ спинномозговой жидкости часто показывает высокую концентрацию белка и плейоцитоз с преобладанием нейтрофилов или лимфоцитов, однако эти изменения не патогномоничны для неврологической формы ИПК и в некоторых случаях результаты анализа спинномозговой жидкости (СМЖ) оказываются нормальными.6,7 Обнаружение антител в сыворотке имеет ограниченную значимость, так как антитела к коронавирусу присутствуют у большого процента здоровых кошек, но ИПК не развивается; тем не менее очень высокие титры (R1:1600) считаются основанием для подозрения на ИПК.10 Обнаружение коронавируса кошек в крови методом полимеразной цепной реакции (ПЦР) - высокочувствительный, но низкоспецифичный метод при клиническом заболевании.10 ПЦР позволяет точно дифференцировать выпот, обусловленный ИПК, от других типов выпота, кроме того, с его помощью можно анализировать СМЖ для диагностики неврологической формы ИПК10; однако автору неизвестно о каких-либо исследованиях чувствительности и специфичности анализа СМЖ на коронавирус кошек методом ПЦР.
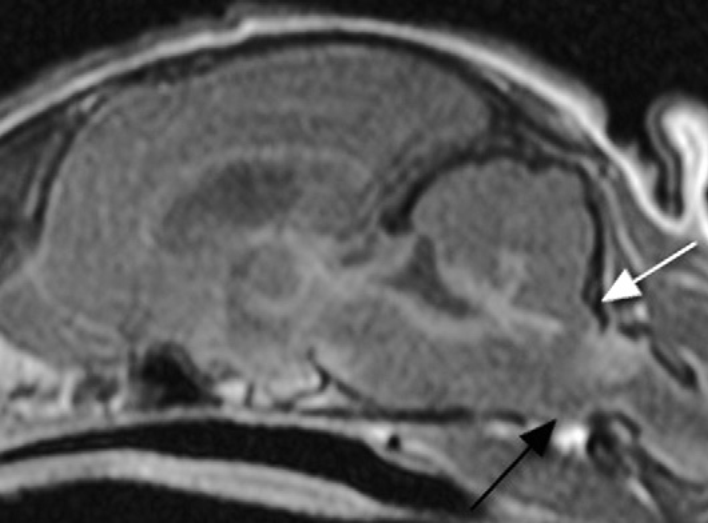
Рис. 1. Сагиттальное T1-взвешенное изображение после введения контраста у 11-месячной кошки породы сфинкс с предположительным диагнозом ИПК. Видно расширение желудочков и усиление контраста выстилки желудочков, указывающее на эпендимит, локальная зона усиления контраста в паренхиме мозга на границе продолговатого мозга и шейного отдела спинного мозга (черная стрелка) и субтенториальная грыжа мозга (белая стрелка).
Лечения ИПК с доказанной эффективностью не существует. Описано лечение кортикостероидами, циклофосфамидом, озагрела гипохлоридом, рибавирином, мелфаланом, тилозином, промодулином, человеческим интерфероном α, кошачьим интерфероном β или ω, Propionibacteriumacnes, пентоксифиллином и полифениловым иммуностимулятором (отдельно или в сочетании), при этом у некоторых кошек наступала ремиссия клинических симптомов.16,17 Возможно, что в некоторых из этих случаев ремиссия была спонтанной или диагноз был ошибочным; результаты некоторых из этих исследований необходимо интерпретировать с осторожностью.16
Опухоли
Опухоли – распространенная причина поражения спинного мозга, описанная примерно в 25% случаев.1,4 Лимфосаркома – самая распространенная опухоль спинного мозга у кошек, составляющая от 28 до 40% случаев.1,2,4 На втором месте по распространенности находилась остеосаркома, составлявшая 27% (14/52) случаев нелимфоидных опухолей; в этом же исследовании глиальные опухоли (9%) и менингиома (7%) были на третьем и четвертом месте по частоте среди опухолей, поражающих спинной мозг кошек (рис. 2).2 В противоположность этому, в двух ретроспективных исследованиях с участием 37 кошек с нелимфоидными опухолями позвоночника или спинного мозга, которых лечили путем хирургической резекции с целью уменьшения объема опухоли, менингиома была наиболее частым типом, составлявшим примерно половину (45-61%) всех случаев.18,19 В исследовании Rossmeisl с соавторами19 менингиома была самой распространенной доброкачественной опухолью (16/18), а остеосаркома – злокачественной (3/8). В исследования Levy и Rossmeisl не включали неоперабельные опухоли, поэтому результаты не учитывают внутримозговые опухоли, такие как глиомы и примитивные нейроэктодермальные опухоли (ПНЭО), а также высокоинвазивные и разрушающие опухоли, например остеосаркомы и фибросаркомы.18,19
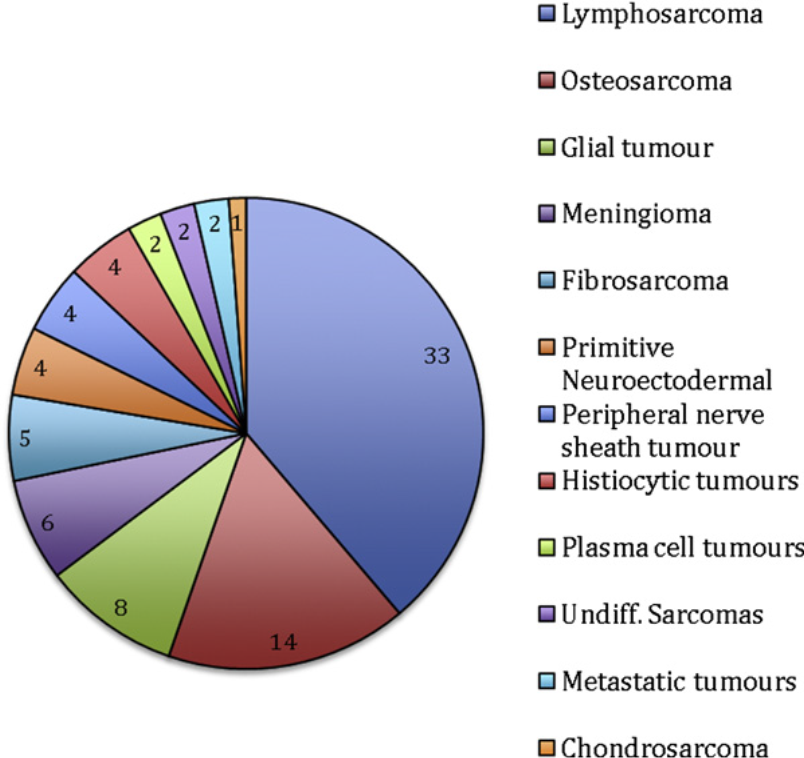
Рис. 2. Распространенность опухолей в популяции 85 кошек с гистологически подтвержденными первичными или метастатическими опухолями спинного мозга, либо опухолями, прорастающими в спинной мозг из соседних тканей.
Лимфосаркома
Лимфосаркома была самой распространенной опухолью по результатам ретроспективного исследования 85 кошек с окончательным диагнозом новообразования спинного мозга.2 В этом исследовании кошки с диагнозом лимфосаркомы спинного мозга были значительно моложе (средний возраст и медиана 6 и 4 года), чем кошки с другими опухолями спинного мозга (средний возраст и медиана 9 и 10 лет).2 Распределение кошек с опухолями, не относящимися к лимфосаркоме, было нормальным, 80% животных были в возрасте от 5 до 14 лет; при этом возрастное распределение кошек с лимфосаркомой было бимодальным, 50% животных моложе 4 лет и 25% старше 11 лет.2 К самым распространенным клиническим признакам лимфосаркомы спинного мозга у кошек относятся прогрессирующий асимметричный паралич или парез задних конечностей и гиперестезия позвоночника,2,20 как и при других опухолях спинного мозга; однако у кошек с лимфосаркомой чаще наблюдались неспецифические клинические симптомы, такие как потеря аппетита, вялость, потеря веса, симптомы респираторной инфекции и аномальное поведение.2 Присутствие неспецифических клинических признаков можно объяснить подавлением иммунитета в результате инфекции вирусом лейкоза кошек (FeLV) у 56% кошек с лимфосаркомой и поражением других органов, которое было обнаружено при вскрытии 85% кошек.2 По данным предыдущих исследований процент кошек, инфицированных вирусом лейкоза, достигал 94%,20 а процент кошек с поражением органов, не относящихся к нервной системе, составлял 43 - 100%.20,21 Исследование показало, что длительность клинических симптомов до постановки диагноза у кошек с лимфосаркомой была значительно меньше, чем у кошек с другими опухолями спинного мозга; 93% кошек с лимфосаркомой спинного мозга болели менее 2 месяцев до постановки диагноза.2
Лимфосаркому спинного мозга сложно диагностировать прижизненно. Поставить диагноз по результату цитологического исследования мазков крови удается в 5-13% случаев, костного мозга – в 14-67% случаев, а спинномозговой жидкости – в 9-35% случаев.2,20 Вариабельность положительных результатов в трех рассмотренных исследованиях сложно объяснима; все они были ретроспективными посмертными исследованиями со сходным размером выборки;23–33 возможно, что разница в процентных соотношениях положительных результатов исследований invivo обусловлена малым числом случаев. Возможно, что сочетание различных диагностических методов, таких как анализ спинномозговой жидкости и пунктата костного мозга, повысит вероятность диагностического результата. По-видимому, наиболее вероятным способом постановки окончательного диагноза лимфосаркомы спинного мозга является обнаружение новообразований внутри или за пределами нервной системы при клиническом осмотре и визуальной диагностике (рентген грудной клетки, УЗИ брюшной полости, рентген позвоночника, МРТ или миелография) с последующей тонкоигольной аспирацией или биопсией новообразования при возможности.2
Почки и костный мозг – наиболее распространенные органы за пределами нервной системы, поражающиеся при лимфосаркоме спинного мозга, судя по данным из 5 публикаций; таким образом, исследование этих органов может помочь поставить прижизненный диагноз лимфосаркомы.2,3,20–22 Среди кошек с лимфосаркомой спинного мозга доля животных с поражением почек составила 41-100%,2,20 а костного мозга – 45-54%.2,22 В исследовании Marioni-Henry с соавторами2 лимфосаркома была обнаружена в печени (36%), скелетных мышцах (32%), селезенке или лимфатических узлах (27%), а также позвонках или сердце (18%). Лимфосаркома ЦНС имеет тенденцию к распространению в разные участки спинного мозга, особенно грудной и пояснично-крестцовый отделы, а также головной мозг; два исследования с вскрытием показали поражение головного мозга у 31-43% кошек с лимфосаркомой спинного мозга.2,3 Лимфосаркома спинного мозга может располагаться исключительно экстрадурально, что наблюдается в 85-96% случаев, описанных с конца 1970 гг до начала 1990 гг20–22; однако в более новых публикациях частота исключительно экстрадуральной лимфосаркомы у кошек оценивается как 34-38%, при этом в большинстве случаев (61-88%) обнаруживаются как экстра-, так и интрадуральные компоненты.2,3 Прогноз при лимфосаркоме спинного мозга неблагоприятный. Spodnick с соавторами22 описали полную или частичную ремиссию у 6 кошек с лимфосаркомой спинного мозга, получавших винкристин, циклофосфамид и преднизолон; частота полной ремиссии составила 50%, а медиана длительности - 14 недель. Еще у одной кошки, которой провели хирургическую декомпрессию и химиотерапию, ремиссия длилась 62 недели. Lane с соавторами20 описали 4 кошек с лимфосаркомой позвоночника. Три кошки получали L-аспарагиназу, винкристин и преднизолон после местной лучевой терапии позвоночника, а одной кошке была проведена хирургическая резекция для уменьшения объема опухоли; состояние трех кошек улучшилось, и одна из них была жива через 13 месяцев после первого осмотра, однако 3 оставшиеся кошки умерли или подверглись эутаназии в течение 20 недель после начала терапии из-за системного рецидива. В исследовании Marioni-Henry с соавторами2 одна кошка с лимфосаркомой позвоночника подверглась эутаназии после рецидива клинических симптомов через 38 дней после однократной дозы локальной лучевой терапии и лечения преднизолоном, циклофосфамидом и винкристином; еще одна кошка прожила 60 дней после хирургической резекции для уменьшения объема опухоли и лечения преднизолоном, аспарагиназой и цитарабином.
Остеосаркома
Остеосаркома кошек чаще поражает скелет конечностей, чем осевой. По данным ретроспективного исследования новообразований кошек, в 58% из 19 случаев остеосаркомы был поражен скелет конечностей и только в двух случаях - позвонки.23 В другом ретроспективном исследовании 22 случаев остеосаркомы у кошек всего у 32% животных был поражен осевой скелет, а случаев поражения позвонков не было.24 Тем не менее остеосаркома позвонков оказалась второй по частоте опухолью по результатам посмертного ретроспективного исследования 85 кошек с новообразованиями спинного мозга, так как была обнаружена у 14 кошек,2 кроме того, описано еще 9 кошек с гистологически подтвержденной остеосаркомой позвонков.18,19,25–28 Если обобщить эти данные, 14 кошек из исследования Marioni-Henry с соавторами2 и 9 других кошек с остеосаркомой позвонков имели средний возраст 8,3 года (медиана 8 лет, диапазон 3-13 лет), среди них было 12 котов и 11 кошек, 19 кошек принадлежали к домашним короткошерстным (ДКШ), 1 – к персидской и 1 – к ангорской породе.18,19,25–28 В 9 случаях были поражены поясничные позвонки, в 7 случаях – грудные, в 4 случаях – шейные, и в 1 случае – крестцовые и хвостовые.2,18,19,25–28 Рентгеновские снимки показали литические поражения в 10 из 11 случаев и патологический перелом позвонка в 2 случаях; КТ показала патологический перелом, невидимый на рентгеновском снимке, в 1 случае. Миелография, проведенная в 5 случаях, показала компрессию с отклонением или полным прекращением тока контрастного вещества во всех случаях.2,26–28 В 2 случаях при МРТ было обнаружено новообразование позвонка (рис. 3).2 Тонкоигольная аспирация была проведена в 3 случаях; при цитологическом анализе один очаг был диагностирован как новообразование, а второй – как остеосаркома, и еще в одном случае был поставлен ошибочный диагноз лимфосаркомы.2
Хирургическая резекция для уменьшения объема опухоли позволяет увеличить время выживания кошек с остеосаркомой позвонков, однако результаты сильно варьируют. Среднее и медиана времени выживания 5 кошек после хирургической резекции остеосаркомы позвонка составили 145 и 88 дней (диапазон 2–518 дней)2,18,19,25–28; 3 из этих кошек входили в группу из 26 животных, участвовавших в ретроспективном исследовании хирургического лечения нелимфоидных новообразований спинного мозга.19 Это исследование показало, что хирургическая резекция для уменьшения объема опухоли является хорошим паллиативным методом, однако прогноз был основан на фенотипе опухоли и оценки полноты резекции хирургом; фактически медиана времени выживания кошек со злокачественными опухолями (в том числе в 3 случаях остеосаркомы) составила110,5 дней, а кошек с доброкачественными опухолями – 518 дней.19
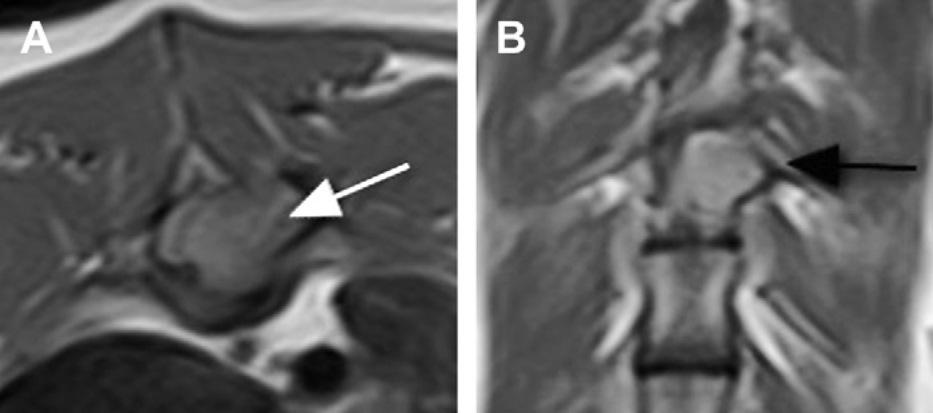
Рис. 3. Остеосаркома позвонка у ДКШ кошки. Поперечное Т1-взвешенное (А) и дорсальное Т1-взвешенное (В) изображения после введения контраста показывают новообразование с однородным усилением контраста, связанное с левой ножкой дуги и телом 10 грудного позвонка (стрелка). (С любезного разрешения SergioRodenas и SoniaAnor, неврологическая служба, ветеринарный колледж, университет Барселоны)
Менингиома
Менингиома – самая распространенная внутричерепная опухоль у кошек, составляющая 58% случаев по данным недавнего исследования29; однако на менингиому спинного мозга пришлось всего 7% случаев в исследовании кошек с гистологически подтвержденными опухолями спинного мозга2 и 8% случаев опухолей спинного мозга кошек, обнаруженных при МРТ.4 Судя по описанным в литературе 32 случаям менингиомы спинного мозга у кошек, средний возраст и медиана составляют 9,7 и 9 лет (диапазон 5-14 лет), большинство кошек принадлежит к ДКШ (20/27), распределение по полу одинаково (59% котов), а опухоль чаще всего поражает грудной отдел позвоночника (19 иди 59% случаев) по сравнению с шейным (7 случаев) или поясничным (6 случаев) отделами.2,18,19,30–34 Во всех случаях, в которых сообщаются результаты рентгенографии, обзорные снимки позвоночника не показали патологии; при миелографии было обнаружено нарушение тока контрастного вещества на уровне опухоли, а в 2 случаях, когда проводили МРТ, опухоль выглядела как зона сильного и однородного усиления контраста (рис. 4).2,18,19,30–34 В двух исследованиях сообщаются данные о выживании кошек после хирургической резекции с целью уменьшения объема опухоли. По данным Levy с соавторами,18 медиана времени выживания у 4 кошек составила 180 дней (диапазон 30-600 дней), а пятая кошка была жива через 1400 дней после операции. Rossmeisl с соавторами19 сообщили, что медиана времени выживания 16 кошек составила 426 дней (диапазон 211-842 дня); 1 кошка в первом исследовании и 5 кошек во втором исследовании подверглись эутаназии из-за других нарушений, и во многих случаях причина эутаназии была неизвестна.
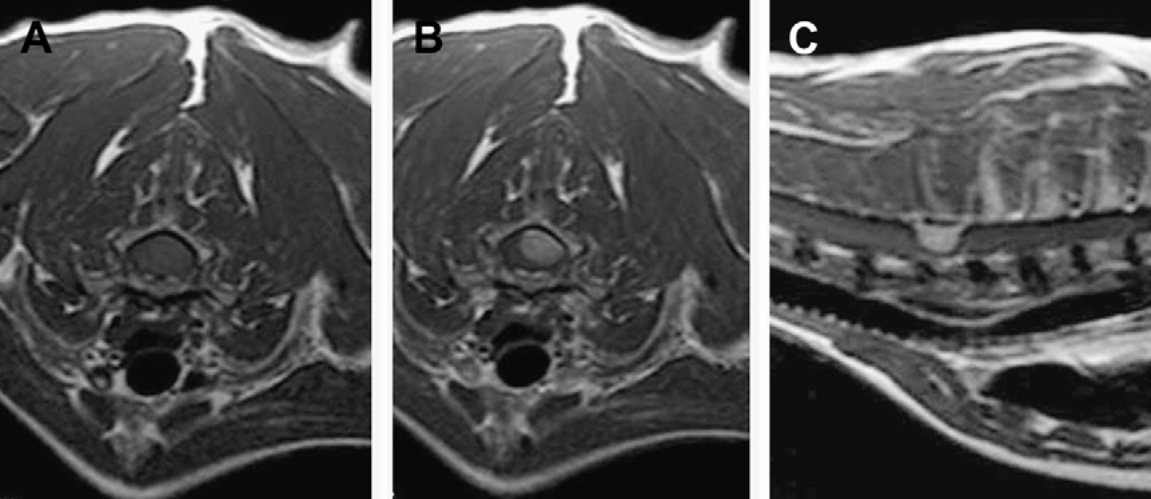
Рис. 4. Менингиома у 12-летнего норвежского лесного кота. Т1-взвешенные изображения в поперечной плоскости до (А) и после (В) введения контраста и изображение в сагиттальной плоскости после введения контраста (С) на уровне первого грудного позвонка показывают новообразование с однородным усилением контраста и ровными границами, смещающее спинной мозг вправо. (С любезного разрешения DrRodolfoCappello, NorthDownsSpecialistsReferrals, Блетчингли, Суррей, Великобритания.)
Травма межпозвонкового диска
Заболевания межпозвонковых дисков (МПД) у кошек редки. По оценкам, их частота составляет от 0,02 до 0,12%, в то время как у собак – 2%.35 При посмертном исследовании кошек с заболеваниями МПД, проведенном в 1958 году, была обнаружена протрузия дисков как I типа по Хансену (хондроидная дегенерация диска с полной перфорацией фиброзного кольца), так и II типа (фиброзная дегенерация с выбуханием фиброзного кольца).36King с соавторами36 обнаружили выбухание диска в дорсальном направлении у каждой четвертой произвольно взятой кошки в местных клиниках общего профиля, единственным критерием исключения была тяжелая травма позвоночника. В этом же исследовании к I типу по Хансену относилось всего 18% (16/91) случаев; при обоих типах чаще всего поражались шейные диски, в основном С6-7; другой пик частоты приходился на межпозвонковые пространства L4-5.36King завершил второе посмертное исследование в 1960 г, разделив протрузию диска II типа на незначительную и значительную. В этом исследовании выбухание диска чаще встречалось в шейном отделе, чем в области T10-S1; однако если учитывать только I тип, частота выбухания диска в шейном отделе и области T10-S1 была сходной (рис. 5A).37 Если учитывать незначительные протрузии II типа, наибольшая частота наблюдалась в области C2-3 и T10-S1, а пик частоты приходился не на границу между поясничным и грудным отделами, как у собак, а на L4-5.37 Протрузия дисков чаще обнаруживалась у кошек старшего возраста, особенно старше 15 лет.38
За период с 1981 г до ноября 2009 г разные исследователи опубликовали отдельные случаи или серии случаев заболеваний МПД у кошек, в том числе 17 работ, описывающих 44 кошек с клиническими симптомами (общее число пораженных дисков = 50).1,35,39–53 Один случай, описанный в 1971 г, не учитывается, так как автор позднее включил этот случай в исследование лимфосаркомы позвоночника.54 На основании данных, представленных в этих публикациях, а также данных 8 кошек из исследования Marioni-Henry с соавторами,1 медиана и средний возраст кошек с клиническими признаками заболевания МПД составляет 8 лет (диапазон 1,5-17 лет; 28 котов и 16 кошек). Двадцать две кошки были ДКШ, 10 – домашними длинношерстными, 2 – домашними среднешерстными, а 10 (22%) – чистопородными кошками. У 13 из 43 кошек клинические признаки развились остро, а у 30 из 43 (70%) – прогрессировали постепенно. Гиперестезия позвоночника отмечалась у 22 из 24 (92%) кошек. Протрузия диска I типа по Хансену была обнаружена у 30 из 45 (67%) кошек, а II типа - у 15 из 45 кошек. Чаще всего поражались межпозвонковые диски L4-5 (9 кошек), L7-S1, (7 кошек) и T13-L1 (6 кошек) (рис. 5B). Два описания серий случаев посвящены заболеваниям межпозвонковых дисков поясничного и пояснично-грудного отделов у кошек, таким образом, оценка распределения могла оказаться искаженной в сторону завышения частоты поражения в этих отделах, однако в исследовании KingandSmith37 также обнаружен пик частоты протрузии межпозвонкового диска обоих типов в области L4-5. Посмертные исследования показали высокую частоту протрузии дисков в шейном отделе, что реже встречалось у кошек с клиническими симптомами. Высказано предположение, что протрузия диска в шейном отделе не вызывает клинических симптомов из-за относительно большого диаметра позвоночного канала.38
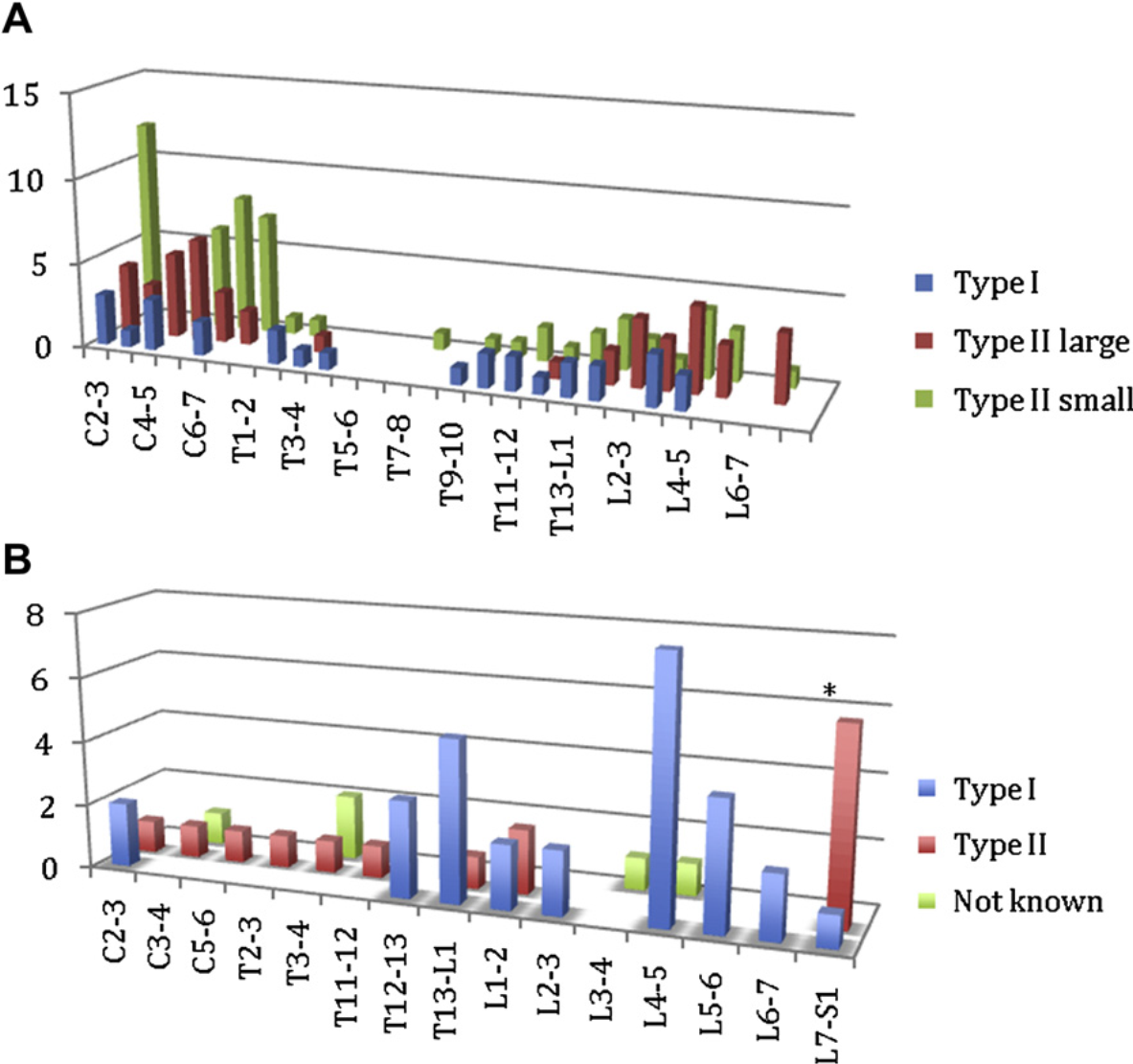
Рис. 5 (А).Распространенность протрузии межпозвонковых дисков в популяции 100 клинически здоровых кошек (135 протрузий). (Источник: King AS, Smith RN. Disc protrusion in the cat: distribution of dorsal protrusion along the vertebral column. VetRec 1960;72:335–7; с изменениями; с разрешения.)
(В)Распространенность протрузии межпозвонковых дисков в популяции 44 кошек с клиническими симптомами (50 протрузий) по данным, опубликованным в ветеринарной литературе с 1981 по 2009 гг.1,35,39–53 Включены данные исследования, в котором оценивались только заболевания межпозвонковых дисков L7-S1 у 6 кошек.
Вероятно, что повышенная частота поражения межпозвонковых дисков в определенных зонах позвоночника связана с его конфигурацией при опоре и с амплитудой движений позвоночника кошек. Рентгенографическое исследование позвоночного столба кошек показало, что при опоре на конечности позвоночник слегка сгибается дорсально в нижних поясничных сегментах, заметно сгибается вентрально в нижних грудных и верхних поясничных сегментах и очень сильно – дорсально в краниальных грудных (выше Т9) и шейных сегментах.55 В этом же исследовании оценивались средние углы при опоре на конечности относительно амплитуды движений, при этом обнаружено, что во время опоры нижние поясничные межпозвонковые суставы (L4-5 - L6-7) почти максимально согнуты дорсально, а суставы от T10 до T13 максимально выгнуты вентрально, в то время как остальные суставы находятся в среднем положении; это может объяснить повышенную частоту поражения межпозвонковых дисков T12-L1 и L4-6 у кошек с клиническими симптомами (см. рис. 5B).55 Исследования клинически больных и здоровых кошек также показали возможность поражения МПД в необычных участках, например, T2-3 и T3-4 (см. рис. 5). Это нехарактерные места, так как диски между Т1 и Т10 у собак и Т1-Т11 у кошек покрыты межголовковой связкой, соединяющей головки противоположных ребер, проходя над межпозвонковым диском и через дно позвоночного канала. Полагают, что у собак эта связка обеспечивает дополнительную поддержку диска и предохраняет его от выбухания37,56 однако позвоночный столб кошек очень гибок и позволяет скручивание почти на 180°, которое происходит большей частью на небольшом отрезке грудного отдела примерно от Т4 до Т11.56 Другой причиной гибкости является отсутствие сустава между лопаткой и осевым скелетом, вместо этого туловище поддерживают мышцы (мышца, поднимающая лопатку, вентральная лестничная мышца, а также большая и малая ромбовидные мышцы), берущие начало на медиальной поверхности лопатки у дорсального края и веерообразно расширяющиеся на туловище наподобие строп.56 Эти мышцы удерживают туловище подвешенным между лопатками, как канаты подвесного моста, и помогают стабилизировать туловище от вращательных движений.56 Общий вектор поддерживающей силы между лопаткой и туловищем пересекает позвоночный столб около соединения Т2-3.56 Таким образом, возможно, что близость очень гибкой области (Т4-11) к гораздо более стабильной области (Т2-3) позвоночника кошки может привести к поражению межпозвонковых дисков в этих местах, особенно при травмах; фактически в двух случаях заболевания межпозвонковых дисков Т2-3 и Т3-4 упоминалась травма.1
Часто заболевания МПД у кошек удается успешно лечить, особенно при хирургической декомпрессии спинного мозга. У 16 из 30 кошек, которых лечили хирургически, был получен превосходный результат, то есть возврат к норме; у 5 кошек результат был хорошим с некоторыми остаточными неврологическими нарушениями; у 5 кошек был получен удовлетворительный результат, 3кошки оказались недоступны для наблюдения, и 1 кошка умерла.1,35,39-53 Из 10 кошек, которых лечили консервативно, у 3 – был получен хороший результат, а у 1 – превосходный результат после лечения кортикостероидами, иглоукалыванием и физиотерапией. У одной из кошек, получавших консервативное лечение, результат оказался плохим, 1 кошка умерла, а 4 кошки подверглись эутаназии; оставшиеся 5 кошек подверглись эутаназии сразу после постановки диагноза.1,35,39-53
Врожденные заболевания
У кошек встречаются врожденные заболевания, поражающие спинной мозг; они перечислены в этом разделе и обсуждаются в статье WestworthandSturges о врожденных заболеваниях спинного мозга, опубликованной в этом выпуске. Дизгенез крестцово-хвостового отдела представляет собой сочетание врожденных пороков развития, распространенное у мейн-кунов и их метисов; при этом могут поражаться поясничный, крестцовый и хвостовой отделы, что часто сопровождается пороками развития спинного мозга, такими как миелодисплазия, гидромиелия и/или сирингомиелия, менингоцеле или менингомиелоцеле, а также «фиксированный» спинной мозг.57-59 К прочим врожденным заболеваниям спинного мозга кошек относятся кистоподобные изменения, такие как арахноидальная киста спинного мозга,60-65 интрадуральная эпителиальная киста спинного мозга,66 дермоидная киста и синус,67,68 а также пороки развития позвонков, приводящие к компрессии спинного мозга, такие как гипоплазия зубовидного отростка с вторичным вывихом атлантоосевого сустава и множественные хрящевые экзостозы.57
Сосудистые заболевания
На сосудистые заболевания, поражающие спинной мозг, пришлось 9% случаев в посмертном ретроспективном исследовании 205 кошек с заболеваниями спинного мозга, а в исследовании 92 кошек с клиническими симптомами поражения спинного мозга при помощи МРТ в 6,5% случаев подозревали ишемическую миелопатию.1,4 В первом исследовании у 15 из 19 кошек старшего возраста (медиана 9 лет) были обнаружены сосудистые изменения, поражающие различные сегменты спинного мозга (11/15) и головной мозг (5/15). Самым распространенным поражением было размягчение спинного мозга, в некоторых случаях из-за васкулопатии (5/15); кроме того, были обнаружены кровоизлияния (5/15) или тромбоз (4/15).1 В четырех случаях анамнез и гистологические признаки тяжелого некроза серого и белого вещества пояснично-грудных сегментов спинного мозга с вентролатеральной стороны указывали на ишемическую полимиеломаляцию, связанную с тяжелой компрессией в брюшной полости и длительными спазмами поясничных артерий.69 В четырех случаях сосудистой миелопатии в исследовании автора описано очаговое размягчение; его причину установить не удалось, хотя подозревалась травма, заболевание межпозвонкового диска или эмболия волокнистым хрящом.1
Эмболия волокнистым хрящом
Эмболия волокнистым хрящом (ЭВХ) – нечастое явление у кошек; однако опубликованных случаев предполагаемой или подтвержденной ЭВХ становится все больше, возможно, из-за распространения МРТ, повышающей индекс вероятности у выживших кошек и позволяющей лучше установить локализацию очага для гистологического исследования. Причиной ЭВХ становится мелкий фрагмент дегенеративного диска, закупоривающий сосуд, снабжающий кровью спинной мозг, что приводит к ишемической некротизирующей миелопатии.70 Точная патологическая физиология ЭВХ неизвестна. Предполагается, что выбухающее студенистое ядро, перемещаясь к спинному мозгу, в первую очередь достигает сосудов, снабжающих кровью тело позвонка, либо диск выбухает непосредственно в зону сосудов спинного мозга или персистирующие эмбриональные артерии фиброзного кольца, а также аномальные сосуды; кроме того, вещество диска может проникать в сосуды, достигающие студенистого ядра после хронического воспаления.71
На основании данных, опубликованных в ветеринарной литературе, ЭВХ чаще поражает кошек старшего возраста, клинические признаки обычно прогрессируют менее 24 ч, часто бывают односторонними и ограничиваются шейным и грудным отделом (рис. 6).70–77
У 14 кошек с ЭВХ (9 подтвержденных случаев и 5 подозреваемых) со средним возрастом 9 лет (медиана 10 лет, диапазон 4-12 лет) не было выявлено породной или половой предрасположенности. Средняя длительность прогресса клинических признаков и медиана составили 19 и 16 часов; однако в двух случаях прогресс длился более 24 ч, а в одном случае через 24 ч после начального появления симптомов и восстановления произошел рецидив. Самыми распространенными клиническими признаками были тетра- или гемипарез или гемиплегия (9/14), за которыми следовали парез/параплегия задних конечностей и синдром Хорнера, по 5 случаев каждого. Пункцию спинномозговой жидкости сделали в 9 случаях; в 5 случаях анализ спинномозговой жидкости показал нейтрофильный плейоцитоз, в 2 случаях результат был нормальным, в 1 случае наблюдалась белково-клеточная диссоциация, а в 1 случае – загрязнение кровью. Миелографию делали в 3 случаях; во всех был обнаружен отек спинного мозга. МРТ проводили в 9 случаях, при этом были обнаружены интрамедуллярные очаги, гипо- или изоинтенсивные по отношению к нормальному серому веществу на Т1-взвешенных изображениях и гипоинтенсивные на Т2-взвешенных изображениях, с незначительным поглощением контраста или без поглощения. По данным MacKay с соавторами,76 время появления усиления, указывающего на инфаркт, варьирует; при проведении МРТ в течение нескольких часов после инфаркта усиления может не быть, в то время как 5-6 дней спустя усиление после введения контраста на основе гадолиния более очевидно. Шейно-грудное утолщение было областью спинного мозга с наибольшей частотой ЭВХ, подозреваемой или подтвержденной (50%), на втором месте находилось пояснично-крестцовое утолщение (21% случаев); результаты исследования собак говорят о том, что подтвержденная ЭВХ чаще всего возникает в области пояснично-крестцового утолщения (47%), за которым следует шейно-грудное утолщение (31%).78 Девять кошек подверглись эутаназии, и ЭВХ была подтверждена при гистологическом исследовании спинного мозга, а также на основании обширного размягчения и видимых эмболов из волокнистого хряща (см. рис. 6В). Три кошки полностью восстановились через 2-6 недель, а состояние двух кошек значительно улучшилось; через 3-7 недель сохранились лишь легкие нарушения осознанных проприоцептивных реакций.71,74,77
Несмотря на то, что описано всего 14 случаев ЭВХ, видно, что картина ЭВХ при МРТ была постоянной, наиболее распространенной зоной поражения было шейно-грудное утолщение, а клинические симптомы были выражено односторонними, особенно при поражении шейного отдела. Возможно, что высокая частота ЭВХ в зоне шейно-грудного утолщения объясняется высокой распространенностью дегенерации и выбухания межпозвонкового диска в этой области у кошек.36,37 Кроме того, соединение между шейным и грудным отделом участвует в движениях головы и шеи у четвероногих животных, особенно при опускании головы.79 Одно из возможных объяснений выраженной односторонности симптомов может быть связано с артериями, снабжающими кровью спинной мозг собак и кошек. Приблизительно половина центральных артерий спинного мозга кошек дает ветви попеременно вправо и влево, в то время как другие центральные артерии имеют общий ствол и снабжают кровью обе стороны; в шейном отделе немного больше односторонних центральных артерий (55%) по сравнению с грудным (49%) и поясничным (47%) отделами.80
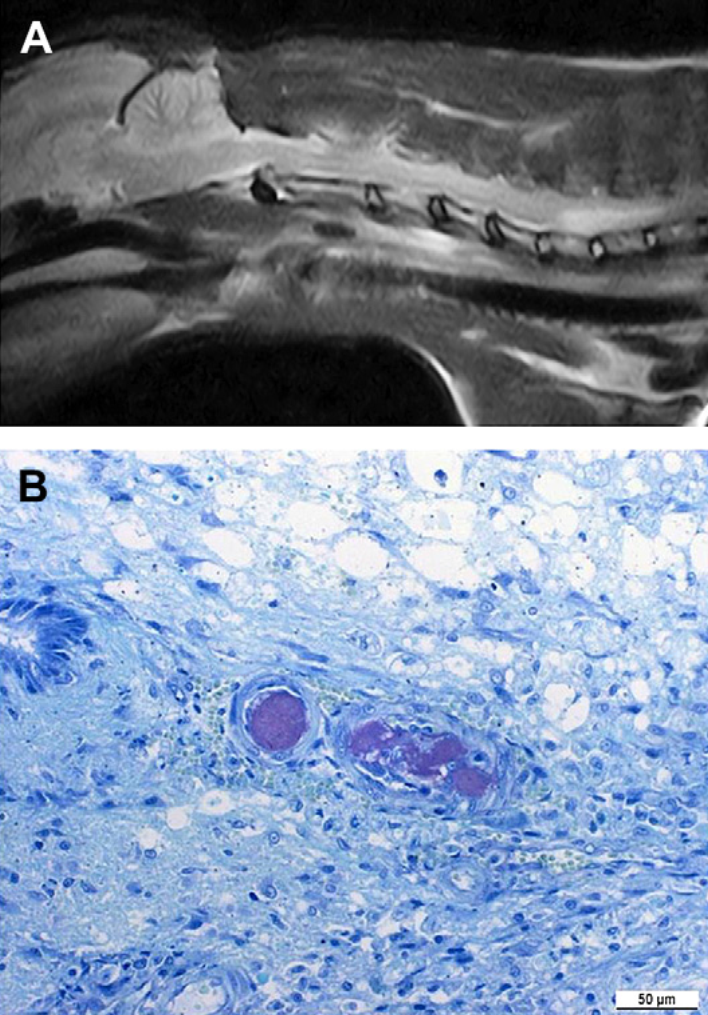
Рис. 6. Эмболия волокнистым хрящом у 9-летней ДКШ кошки.(А)Сагиттальное Т2-взвешенное изображение каудальной части шейного отдела спинного мозга. Виден гиперинтенсивный интрамедуллярный очаг, простирающийся от шестого шейного до первых грудных позвонков, а также 2 дегенеративных межпозвонковых диска между третьим и пятым шейными позвонками.
(В)Гистологический срез каудальной части шейного отдела спинного мозга кошки, показанной на рис. 6А. В препарате, окрашенным толуидиновым синим, видны эмболы из волокнистого хряща (окрашены в пурпурный цвет), заполняющие просвет сосуда в некротической части спинного мозга (исходное увеличение х 50 мм). (С любезного разрешения SergioRodenas, SoniaAnor и MartiPumarola, служба неврологии и патологии, ветеринарный колледж, Университет Барселоны)
Пороки развития внутрикостных сосудов
Пороки развития внутрикостных сосудов (ПРВС), приводящие к компрессии спинного мозга, описаны у 3 молодых кошек в возрасте 15 и 20 месяцев с хроническим прогрессирующим парезом задних конечностей на протяжении 3-12 месяцев, частично отвечавшим на кортикостероидную терапию.81 В некоторых случаях ПРВС по клинической картине сходны с опухолевыми заболеваниями; на рентгеновских снимках было видно очаговое снижение плотности кости или лизис грудных позвонков Т2, Т4 и Т10-Т11, соответственно; миелография во всех случаях показала препятствие для тока столбика контрастного вещества или экстрадуральную компрессию.81 Изменение описывалось как сосуды разного размера с эндотелиальными клетками, выраженными перицитами и различным количеством гладких мышц среди рыхлой соединительнотканной стромы, разделенной пластинчатыми костными траберкулами, с остеобластами и редкими остеокластами.81 Пролиферация костной ткани и сосудов вызывала сильную компрессию спинного мозга. Несмотря на агрессивность пролиферации сосудов, WellsandWeisbrode81 считали такие очаги пороками развития на основании молодого возраста кошек и хорошей дифференциации сосудов, в том числе эндотелия, перителия, гладкомышечных и фиброзных клеток.
Миелопатия в результате свища между аортой и полой веной
В недавней публикации описывается миелопатия, развившаяся в результате свища между аортой и полой веной у 15-месячного кота ДКШ с прогрессирующим парапарезом на протяжении 3 месяцев.82 При УЗИ брюшной полости была обнаружена аневризма каудальной полой вены и аномальный сосуд, отходящий от полой вены. Миелопатия, неселективная ангиография и КТ с контрастом подтвердили свищ между аортой и полой веной и аневризму полой вены с кровенаполненным позвоночным венозным сплетением, вызывавшим двухстороннюю вентролатеральную компрессию спинного мозга на участке от Т12 до L4. Попытки хирургической окклюзии аномального сосуда оказались безуспешны; при вскрытии в вентральных и латеральных частях спинного мозга от Т7 до L4 были обнаружены признаки Уоллеровой дегенерации, более выраженные в сегментах с Т11 по L1. Пороки развития сосудов ЦНС, аналогичные описанному, часто обусловлены нарушениями развития, однако могут быть приобретенными и развиться в результате травмы, разрыва аневризмы артерии или хирургического лигирования кровеносных сосудов.82
Дегенеративные/Наследственные нарушения
К дегенеративным и наследственным заболеваниям спинного мозга у кошек относятся болезни накопления, атрофия мышц позвоночника и дистрофия аксонов или нейронов.83 Другие дегенеративные миелопатии могут быть обусловлены инфекциями или нарушениями питания, например вирусным лейкозом или недостаточностью кобаламина, как описано ниже.84,85 Болезни накопления, поражающие спинной мозг, включают: ганглиозидоз GM1/GM2, описанный у сиамских кошек, коратов и домашних кошек; глюкогеноз IV типа, описанный у норвежских лесных и домашних кошек; сфингомиелиноз (болезнь Нимана-Пика) у сиамских, балинезийских и домашних кошек и мукополисахаридоз VI типа у сиамских и домашних кошек.83,86
Нейроаксональная дистрофия
Нейроаксональная дистрофия (НД) – дегенеративное состояние, характеризующееся набуханием дистальных сегментов аксонов (сфероиды) в ЦНС.87 Полагают, что НД – наследственное заболевание, передающееся по аутосомно-рецессивному типу.88 Клинические признаки: атаксия задних конечностей, прогрессирующая до пареза и паралича, тремор головы и гиперметрия.87 Первоначально НД была описана в 6 пометах трехцветных ДКШ кошек; наиболее выраженными гистологическими изменениями было присутствие сфероидов в стволе мозга, атрофия червя мозжечка и истощение нейронов в спиральных ганглиях.88 Первые клинические признаки у пораженных котят развивались в возрасте 5-6 недель, при этом у них был менее яркий окрас.88 Позднее была описана НД у трех ДКШ кошек с появлением клинических симптомов в возрасте от 7 до 9 месяцев и у двух сиамских кошек с появлением первых симптомов в возрасте 2 недель; у двух сиамских котят и двух ДКШ кошек окрас шерсти был нормальным, и у трех ДКШ кошек не было обнаружено признаков поражения внутреннего уха.87,89
Дегенеративная миелопатия, связанная с вирусом лейкоза кошек
У кошек с хроническим вирусным лейкозом возможны различные неврологические симптомы, в том числе вялость, ненормальное поведение, подача голоса, гиперестезия, недержание мочи и парез задних конечностей, прогрессирующий до паралича.84 В ретроспективном исследовании 16 кошек с хронической инфекцией вирусом лейкоза самым распространенным клиническим признаком был парез задних конечностей, прогрессировавший до паралича в течение 1 года.84 Средний возраст кошек с известной датой рождения составил 9 лет. У всех кошек присутствовали антитела к вирусу лейкоза на протяжении 2 – 4 лет, и всего у 4 из 12 кошек имелись типичные изменения крови, связанные с вирусным лейкозом, такие как анемия, макроцитоз, нейтропения, крупные тромбоциты и тромбоцитопения; у 10 кошек была лимфопения, а результаты анализа ЦНС у 7 кошек не показали особенностей. Гистологическое исследование показало обширные поражения спинного мозга и ствола мозга, характеризовавшиеся дегенерацией белого вещества с расширением миелиновых оболочек; некоторые из расширенных миелиновых оболочек были лишены аксонов, а в других присутствовали неизмененные или набухшие аксоны. Результат иммунохимического окрашивания глиальных клеток, нейронов и эндотелия во всех исследованных срезах спинного мозга на p27 вируса лейкоза был положительным. ДНК провируса была выделена из спинного мозга 5 кошек и из спинного мозга, головного мозга, селезенки и кишечника еще у 5 кошек; результат анализа СМЖ был положительным только у одной кошки.84
Нарушение метаболизма/питания
Гипервитаминоз A
Гипервитаминоз А вызывает метаболическую остеопатию у кошек, получающих рацион на основе печени от нескольких месяцев до года.90 Эта метаболическая остеодистрофия характеризуется костными остеофитами и экзостозами вокруг суставов и участков прикрепления сухожилий, связок и суставной капсулы; чаще всего поражаются затылочная кость, шейные и грудные позвонки.91 В начале костная гиперплазия охватывает краниальные шейные позвонки, затем болезнь прогрессирует на соединения шейных и краниальных грудных позвонков, которые могут слиться и привести к полному костному анкилозу. Патологическая физиология токсического действия витамина А понята недостаточно. Предполагается, что витамин А повышает подвижность клеточных мембран и делает их чувствительными к механическому повреждению, что ведет к формированию экзостозов.92 Кроме того, токсическое действие витамина А подавляет синтез коллагена и приводит к разрушению тканей в месте прикрепления сухожилий мышц к периосту во время мышечной активности, таким образом, усиленная мышечная активность во время вылизывания шерсти у кошек может объяснить предрасположенность шейно-грудных сегментов позвоночника к поражению.91 Боль, снижение подвижности шеи и хромота на передние конечности из-за костных анкилозов и сдавливания нервных корешков – ранние признаки интоксикации витамином А у кошек. В некоторых случаях поражения могут прогрессировать, индуцируя паралич. Рентгенографические признаки интоксикации витамином А у котят, получающих такой рацион, можно увидеть через 15 недель.92 При хроническом и тяжелом поражении прогноз восстановления функции обычно неблагоприятный, и коррекция рациона просто останавливает прогресс клинических симптомов; однако в некоторых случаях после коррекции рациона неврологические нарушения ослабевают.91
Вторичный алиментарный гиперпаратиреоидизм
После появления сбалансированных готовых кормов для животных вторичный алиментарный гиперпаратиреоидизм (ВАГ) в результате хронической недостаточности кальция в рационе, приводящей к повышению концентрации паратгормона в сыворотке и усиленной резорбции костей, стал редким явлением. В прошлом это нарушение часто регистрировалось у щенков и котят, которых кормили исключительно мясом.93 Рацион, бедный кальцием, особенно сильно сказывается на молодых растущих животных с повышенной потребностью в кальции для роста костей и минимальными резервами кальция. В ответ на снижение концентрации кальция в сыворотке повышается секреция и синтез паратиреоидного гормона, что ведет к усилению резорбции костей, реабсорбции кальция/экскреции фосфора в почках и синтезу активного витамина D в почках. Все клинические признаки отражают тяжелую остеопению и гипокальциемию. В публикации, описывающей 6 кошек с ВАГ, сообщается, что 2 кошки с переломом позвоночника вследствие тяжелой остеопении подверглись эутаназии из-за тяжелых неврологических нарушений; состояние оставшихся 4 кошек улучшилось после смены рациона.93
Миелопатия при недостаточности кобаламина
9-летняя кошка с хроническим панкреатином в анамнезе вследствие недостаточности концентрации кобаламина и фолата в сыворотке поступила с прогрессирующей атаксией всех 4 конечностей и тетрапарезом.85 Спинномозговые рефлексы были в норме. При вскрытии была обнаружена двухсторонняя и симметричная дегенерация белого вещества спинного мозга. Тяжелее всего были поражены дорсальные столбы каудальных шейных и шейно-грудных сегментов, сопровождающиеся гибелью большого количества волокон, выраженным астроцитозом, фиброзом и пролиферацией кровеносных сосудов. Концентрация кобаламина и фолата в сыворотке кошки была низкой, а клинические признаки соответствовали экзокринной недостаточности поджелудочной железы, которая была подтверждена гистологическим исследованием железы. Концентрация кобаламина в сыворотке заметно снижена у большинства кошек с экзокринной недостаточностью поджелудочной железы, так как фактор организма, благодаря которому кобаламин всасывается в печени, у кошек вырабатывается только в поджелудочной железе. Вероятно, что хроническая экзокринная недостаточность поджелудочной железы и недостаточность кобаламина привели к тяжелой миелопатии у этой кошки, аналогично тому, как это описано у людей.85
Литература
1. Marioni-Henry K, Vite C, Newton A, et al. Prevalence of diseases of the spinal cord of cats. J Vet Intern Med 2004;18:851–8.
2. Marioni-Henry K, Van Winkle TJ, Smith SH, et al. Tumors affecting the spinal cord of cats: 85 cases (1980-2005). J Am Vet Med Assoc 2008;232:237–43.
3. Bradshaw JM, Pearson GR, Gruffydd-Jones TJ. A retrospective study of 286 cases of neurological disorders of the cat. J Comp Pathol 2004;131:112–20.
4. Goncalves R, Platt S, Llabres-Diaz, et al. Clinical and magnetic imaging findings in 92 cats with clinical signs of spinal cord disease. J Feline Med Surg 2009;11(2):53–9.
5. Simons AF, Vennema H, Rofina JE, et al. A mRNA PCR for the diagnosis of feline infectious peritonitis. J Virol Methods 2005;124:111–6.
6. Kornegay JN. Feline infectious peritonitis: the central nervous system form. J Am Anim Hosp Assoc 1978;14:580–4.
7. Baroni M, Heinhold Y. A review of the clinical diagnosis of feline infectious peritonitis viral meningoencephalomyelitis. Prog Vet Neurol 1995;6:88–94.
8. Kline KL, Joseph RJ, Averill DR. Feline infectious peritonitis with neurologic involvement: clinical and pathological findings in 24 cats. J Am Anim Hosp Assoc1994;30:111–8.
9. Pedersen NC. A review of feline infectious peritonitis virus infection: 1963-2008. J Feline Med Surg 2009;11:225–58.
10. Hartmann K, Binder C, Hirschberger J, et al. Comparison of different tests to diagnose feline infectious peritonitis. J Vet Intern Med 2003;17:781–90.
11. Addie D, Bel_ak S, Boucrat-Baralon C, et al. Feline infectious peritonitis. ABCD guidelines on prevention and management. J Feline Med Surg 2009;11:594–604.
12. Hirschberger J, Hartmann K, Wilhelm N, et al. [Clinical symptoms and diagnosis or feline infectious peritonitis]. Tierarztl Prax 1995;23:92–9 [in Germa]
13. Foley JE, Lapointe JM, Koblik P, et al. Diagnostic features of clinical neurologic feline infectious peritonitis. J Vet Intern Med 1998;12:415–23.
14. Kitagawa M, Okada M, Kanayama K, et al. A feline case of isolated fourth ventricle with syringomyelia suspected to be related with feline infectious peritonitis.
J Vet Med Sci 2007;69:759–62.
15. Okada M, Kitagawa M, Ito D, et al. MRI of secondary cervical syringomyelia in four cats. J Vet Med Sci 2009;71:1069–73.
16. Hartmann K, Ritz S. Treatment of cats with feline infectious peritonitis. Vet ImmunolImmunopathol 2008;123:172–5.
17. Legendre AM, Bartges JW. Effect of polyprenyl immunostimulant on the survival time of three cats with the dry form of feline infectious peritonitis. J Feline MedSurg 2009;11:624–8.
18. Levy MS, Mauldin G, Kapatkin AS, et al. Nonlymphoid vertebral canal tumors in cats: 11 cases (1987-1995). J Am Vet Med Assoc 1997;210:663–4.
19. Rossmeisl J, Lanz O, Waldron D, et al. Surgical cytoreduction for the treatment of non-lymphoid vertebral and spinal cord neoplasms in cats: retrospective evaluation of 26 cases (1990-2005). Vet Comp Oncol 2006;4:41–50.
20. Lane SB, Kornegay JN, Duncan JR, et al. Feline spinal lymphosarcoma: a retrospective evaluation of 23 cats. J Vet Intern Med 1994;8:99–104.
21. Zaki FA, Hurvitz AI. Spontaneous neoplasms of the central nervous system of the cat. J Small Anim Pract 1976;17:773–82.
22. Spodnick GJ, Berg J, Moore FM, et al. Spinal lymphoma in cats: 21 cases (1976–1989). J Am Vet Med Assoc 1992;200:373–6.
23. Engle GC, Brodey RS. A retrospective study of 395 feline neoplasms. J Am AnimHosp Assoc 1969;5:21–31.
24. Bitetto WV, Patnaik AK, Schrader SC, et al. Osteosarcoma in cats: 22 cases(1974-1984). J Am Vet Med Assoc 1987;190:91–3.
25. Liu SK, Dorfman HD, Patnaik AK. Primary and secondary bone tumors in the cat. J Small Anim Pract 1975;15:141–56.
26. O’Brien D. Osteosarcoma of the vertebra causing compression of the thoracic spinal cord in a cat. J Am Anim Hosp Assoc 1980;16:497–9.
27. Wheeler SJ. Spinal tumors in cats. Vet Annu 1989;29:270–7.
28. Radaelli ST, Platt SR, McDonnell JJ. What is your diagnosis? J Small Anim Pract2000;41:84–6.
29. Troxel MT, Vite CH, Van Winkle TJ, et al. Feline intracranial neoplasia: retrospective review of 160 cases (1985-2001). J Vet Intern Med 2003;17:850–9.
30. Ross J, Wybrun RS. A report on the clinical investigation of a paraplegic cat. N ZVet J 1969;17:251–3.
31. Jones BR. Spinal meningioma in a cat. Aust Vet J 1974;50:229–31.
32. Wheeler SJ, Clayton Jones DG, Wright JA. Myelography in the cat. J Small AnimPract1985;26:143–52.
33. Yoshioka MM. Meningioma of the spinal cord in a cat. Compend Contin Educ Pract Vet 1987;9:34–8.
34. Asperio RM, Marzola P, Zibellini E, et al. Use of magnetic resonance imaging for diagnosis of a spinal tumor in a cat. Vet Radiol Ultrasound 1999;40:267–70.
35. Munana KR, Olby NJ, Sharp NJH, et al. Intervertebral disc disease in 10 cats. J Am Anim Hosp Assoc 2001;37:384–9.
36. King AS, Smith RN, Kon VM. Protrusion of the intervertebral disc in the cat. VetRec1958;70:509–15.
37. King AS, Smith RN. Disc protrusion in the cat: distribution of dorsal protrusion along the vertebral column. Vet Rec 1960;72:335–7.
38. Rayward R. Feline intervertebral disc disease: a review of the literature. Vet CompOrthop Traumatol 2002;15:137–44.
39. Seim HB III, Nafe LA. Spontaneous intervertebral disk extrusion with associated myelopathy in a cat. J Am Anim Hosp Assoc 1981;17:201–4.
40. Gilmore DR. Extrusion of a feline intervertebral disk. Vet Med Small Anim Clin
1983;78:207–9.
41. Littlewood JD, Herrtage ME, Palmer AC. Intervertebral disc protrusion in a cat.
J Small Anim Pract 1984;25:119–27.
42. Sparkes AH, Skerry TM. Successful management of a prolapsed intervertebral disc in a Siamese cat. Feline Pract 1990;18:7–9.
43. Bagley RS, Tucker RL, Moore MP, et al. Intervertebral disk extrusion in a cat. VetRadiol Ultrasound 1995;36:380–2.
44. Kathman AS, Cizinauskas S, Rytz U, et al. Spontaneous lumbar intervertebral disc protrusion in cats: literature review and case presentations. J Feline MedSurg 2000;2:207–12.
45. Knipe MF, Vernau KM, Hornof WJ, et al. Intervertebral disc extrusion in six cats. J Feline Med Surg 2001;3:161–8.
46. Lu D, Lamb CR, Wesselingh K, et al. Acute intervertebral disc extrusion in a cat and MRI findings. J Feline Med Surg 2002;4:65–8.
47. McConnell JF, Garosi LS. Intramedullary intervertebral disc extrusion in a cat. VetRadiol Ultrasound 2004;45:327–30.
48. Jaeger G, Early P, Munana K, et al. Lumbosacral disc disease in a cat. Vet Comp
Orthop Traumatol 2004;17:104–6.
49. Smith PM, Jeffery ND. What is your diagnosis? A case of intervertebral disc protrusion in a cat. J Small Anim Pract 2006;47:104–6.
50. Maritato KC, Colon JA, Mauterer JV. Acute non-ambulatory tetraparesis attributable to cranial cervical intervertebral disc disease in a cat. J Feline Med Surg2007;9:494–8.
51. Bo¨ttcher P, Flegel T, Bo¨ttcher IC, et al. Partial lateral corpectomy, for ventral extradural thoracic spinal cord compression in a cat. J Feline Med Surg2008;10:291–5.
52. Harris J, Dhupa S. Lumbosacral intervertebral disk disease in six cats. J Am AnimHosp Assoc 2008;44:109–15.
53. Choi KH, Hill SA. Acupuncture treatment for feline multifocal intervertebral disc disease. J Feline Med Surg 2009;11:706–10.
54. Heavner JE. Intervertebral disc syndrome in the cat. J Am Vet Med Assoc 1971; 159:425–7.
55. Mcpherson JM, Ye Y. The cat vertebral column: stance configuration and range of motion. Exp Brain Res 1998;119:324–32.
56. Evans HE. Arthrology. In: Evans HE, editor. Miller’s anatomy of the dog. Philadelphia:WB Saunders; 1993. p. 219–57.
57. Shell LG. Spinal cord diseases in cats. Vet Med 1998;6:553–64.
58. Leipold HW, Huston K, Blauch B, et al. Congenital defects of the caudal vertebral column and spinal cord in Manx cats. J Am Vet Med Assoc1974;164:520–3.
59. Plummer SB, Bunch SE, Khoo LH, et al. Tethered spinal cord and intradural lipoma associated with a meningocele in a Manx-type cat. J Am Vet Med Assoc 1993;203:1159–61.
60. Grevel V, Schmidt-Oechtering GU, Harms N. Eine arachnoidalzyste bei der Katze. Kleintierpraxis 1989;34:55–62.
61. Shamir MH, Shahar R, Aizenberg I. Subarachnoid cyst in a cat. J Am Anim HospAssoc 1997;33:123–5.
62. Galloway AM, Curtis NC, Sommerland SF, et al. Correlative imaging findings in seven dogs and one cat with spinal arachnoid cysts. Vet Radiol Ultrasound
1999;4:445–52.
63. Vignoli M, Rossi F, Sarli G. Spinal subarachnoid cyst in a cat. Vet Radiol Ultrasound1999;40:116–9.
64. Schmidt MJ, Schachenmayr W, Thiel C, et al. Recurrent spinal arachnoid cyst in a cat. J Feline Med Surg 2007;9:509–13.
65. Sugiyama T, Simpson DJ. Acquired arachnoid cyst in a cat. Aust Vet J 2009;87:296–300.
66. Lujan A, Philbey AW, Anderson TJ. Intradural epithelial cyst in a cat. Vet Rec2003;153:363–4.
67. Henderson JP, Pearson GR, Smerdon TN. Dermoid cyst of the spinal cord associated with ataxia in a cat. J Small Anim Pract 1993;34:402–4.
68. Tong T, Simpson DJ. Spinal dermoid sinus in a Burmese cat with paraparesis. Aust Vet J 2009;87:450–4.
69. Summers BA, Cummings JF, de Lahunta A. Degenerative diseases of the central nervous system. In: Summers BA, Cummings JF, de Lahunta A,editors. Veterinary neuropathology. St. Louis (MO): Mosby-Year Book; 1995.p. 208–350.
70. Zaki FA, Prata RG, Werner LL. Necrotizing myelopathy in a cat. J Am Vet Med Assoc1976;169:228–9.
71. Coradini M, Johnstone I, Filippich, et al. Suspected fibrocartilaginous embolism in a cat. Aust Vet J 2005;83:550–1.
72. Bichsel P, Vandevelde M, Lang J. L’infarctus de la moelle _epinie`re a` la suite d’embolies
fibrocartilagineuses chez le chien and le chat. Schweiz Arch Tierheilkd 1984;126:387–97.
73. Turner PV, Percy DH, Allyson K. Fibrocartilaginous embolic myelopathy in a cat. Can Vet J 1995;36:712–3.
74. Scott HW, O’Leary MT. Fibro-cartilaginous embolism in a cat. J Small Anim Pract
1996;37:228–31.
75. Abramson CJ, Platt SR, Stedman NL. Tetraparesis in a cat with fibrocartilaginous emboli. J Am Anim Hosp Assoc 2002;38:153–6.
76. MacKay AD, Rusbridge C, Sparkes AH, et al. MRI characteristics of suspected acute spinal cord infarction in two cats, and a review of the literature. J FelineMed Surg 2005;7:101–7.
77. Mikszewski JS, Van Winkle TJ, Troxel MT. Fibrocartilaginous embolic myelopathy in five cats. J Am Anim Hosp Assoc 2006;42:226–33.
78. Cauzinille L. Fibrocartilagineous embolism in dogs. Vet Clin North Am Small Anim Pract 2000;
30:155–67.
79. Graf W, de Weale C, Vidal PP, et al. The orientation of the cervical vertebral column in unrestrained awake animals. Brain Behav Evol 1995;45:209–31.
80. Culkin SE, Purinton PT, Oliver JE. Arterial supply to the spinal cord of dogs and cats. Am J Vet Res 1989;50:425–30.
81. Wells MY, Weisbrode SE. Vascular malformations in the thoracic vertebrae ofthree cats. Vet Pathol 1987;24:360–1.
82. Kube SA, Vernau KM, Wisner ER, et al. Myelopathy secondary to aortocaval fistula in a cat. Vet Radiol Ultrasound 2004;45:528–31.
83. Marioni-Henry K. Myelopathy, paresis/paralysis, cats. In: Tilley LP, Smith FW, editors. Blackwell’s five-minute veterinary consult: canine and feline. Ames (IA):Blackwell Publishing; 2007. p. 920–3.
84. Carmichael KP, Bienzle D, McDonnell JJ. Feline leukemia virus-associated myelopathy in cats. Vet Pathol 2002;39:536–45.
85. Salvadori C, Cantile C, De Ambrogi G, et al. Degenerative myelopathy associated with cobalamin deficiency in a cat. J Vet Med A Physiol Pathol Clin Med2003;50:292–6.
86. de Lahunta A, Glass E. Visual system. In: de Lahunta A, Glass E, editors. Veterinary neuroanatomy and clinical neurology. St. Louis (MO): Saunders Elsevier; 2009. p. 389–440.
87. Carmichael KP, Howerth EW, Oliver JE, et al. Neuroaxonal dystrophy in a group of related cats. J Vet Diagn Invest 1993;5:585–90.
88. Woodard JC, Collins GH, Hessier JR. Feline hereditary neuroaxonal dystrophy. Am J Pathol 1974;
74:551–66.
89. Rodriguez F, Espinosa de los Monteros A, Morales M, et al. Neuroaxonal dystrophy in two Siamese kitten littermates. Vet Rec 1996;138:548–9.
90. Goldman AL. Hypervitaminosis A in a cat. J Am Vet Med Assoc 1992;200:1970–2.
91. Polizopoulou ZS, Kazakos G, Patsikas MN, et al. Hypervitaminosis A in the cat: a case report and review of the literature. J Feline Med Surg 2005;7:363–8.
92. Seawright AA, English PB. Hypervitaminosis A and deforming cervical spondylosis of the cat. J Comp Pathol 1967;77:29–39.
93. Tomsa K, Glaus T, Hauser M, et al. Nutritional secondary hyperparathyroidism in six cats. J Small Anim Pract 1999;40:533–9.






