B. Ytrehus, C. S. Carlson, and S. Ekman
Отделение заболеваний диких животных, Национальный ветеринарный институт, Осло, Норвегия (BY); Кафедра популяционной ветеринарии, ветеринарный колледж, Университет Миннесоты, Сент-Пол, Миннесота (CSC); и отделение патологии, фармакологии и токсикологии, Шведский Университет сельскохозяйственных наук, Уппсала, Швеция (SE).
Резюме
Остеохондроз – распространенное и клинически значимое заболевание суставов, встречающееся у людей и различных видов животных, чаще всего свиней, лошадей и собак. Это заболевание определяется как очаговое нарушение энхондрального окостенения; считается, что его этиология многофакторная и единственного фактора, ответственного за все аспекты заболевания, не существует. Чаще всего цитируют такие этиологические факторы, как наследственность, быстрый рост, анатомическая конформация, травма и несбалансированный рацион; однако лишь роль наследственности и анатомической конформации достоверно подтверждена данными научной литературы. Механизм инициации заболевания обсуждается. Предполагают, что начальная стадия патогенеза заключается в формировании хрупкого хряща, нарушении дифференциации хондроцитов, некрозе подхрящевой кости и нарушении кровоснабжения хряща в зонах роста, однако согласно новейшей литературе, нарушения кровоснабжения хряща в зонах роста является наиболее вероятным механизмом. Термин «остеохондроз» применяется для описания самых разнообразных патологических изменений у разных видов животных. Мы предлагаем уточнить эту терминологию, включив определяющие слова: латентный (latens;– поражение, ограниченное эпифизарным хрящом), явный (manifesta; поражения, сопровождающиеся задержкой эндохондрального окостенения) и рассекающий остеохондроз (dissecans; формирование расщелин в суставном хряще). Цель этого обзора – дать общее описание заболевания с особым вниманием к наиболее распространенным теориям, представить результаты недавних научных исследований и наше собственное мнение об этиологии и патогенезе остеохондроза, чтобы лучше понять это очевидно сложное заболевание.
Остеохондроз – распространенное нарушение хрящевых зон роста у домашних животных и людей.5 Заболевание описано у таких животных как свиньи,18 собаки,77 лошади,76 крупный рогатый скот,53 кошки94 и крысы.57 Оно считается наиболее значимой причиной слабости конечностей у свиней55 и часто приводит к хромоте молодых спортивных лошадей76 и собак.45 Кроме того, это клинически значимое заболевание людей.90,100
Этиология остеохондроза интенсивно изучалась; однако исследования тормозила путаница в определении болезни и недостаточное понимание ее патогенеза, особенно формирования первичных поражений. По-видимому, это связано с тем, что большинство исследований было посвящено поражениям, вызывающим клинические признаки или связанные рентгенографические изменения. Однако на такой хронической стадии заболевания полученная информация фактически отражает вторичные дегенеративные и регенеративные процессы, а не первичный процесс (процессы).3 Цель этого обзора – привести общее описание заболевания с особым вниманием к наиболее часто цитируемым теориям, результаты недавних научных исследований и наше собственное мнение об этиологии и патогенезе остеохондроза, чтобы лучше понять это очевидно сложное заболевание.
Остеохондроз — неоднозначный термин, прошедший проверку временем
Остеохондроз или, скорее всего, рассекающий остеохондрит (osteochondritis dissecans) – термин, введенный в 1888 г немецким хирургом Кёнигом61 для описания патологического состояния эпифизарного хряща — состояния, вызывающего предрасположенность к образованию свободных тел в суставах молодых индивидов в отсутствие первичного артрита или значительных травм сустава. Ранее, согласно Nagura78, самыми известными теориями происхождения этих свободных тел были теории Monroe (1726), Laennec (1817) и Broca (1854). Эти ученые считали причиной образования свободных тел травму, пролиферацию околосуставных синовиальных тканей и спонтанный некроз суставного хряща, соответственно. Многие считают термин «рассекающий остеохондрит» благозвучным, но не очень подходящим2, что служило поводом значительных споров (исторический обзор см. в публикации Nagura78); но, тем не менее, термин по-прежнему используется. Многие ученые заменяют термин «остеохондрит» на «остеохондроз»,50 так как общепризнано, что воспаление не является характерной особенностью первичных патологических изменений.
В медицине остеохондроз определяется (в множественной форме) как «идиопатические состояния, характеризующиеся нарушением упорядоченности энхондрального окостенения, в том числе хондрогенеза и остеогенеза, на фоне ранее нормального механизма роста.107 стр. 10 Согласно Siffert,107 это определение включает широкий ряд разных заболеваний, нарушающих рост хряща в суставах, зонах роста и местах прикрепления сухожилий и связок, в том числе болезнь Легга-Кальве-Пертеса (остеонекроз эпифиза проксимальной части бедренной кости), болезнь Кёлера (остеонекроз ладьевидной кости предплюсны или коленной чашки), болезнь Осгуда-Шлаттера (апофизит бугристости большеберцовой кости), болезнь Шейерманна (остеонекроз эпифизов соседних тел позвонков в грудном отделе), инфаркт Фрайберга (остеонекроз эпифизов второй плюсневой кости), болезнь Севера (апофизит пяточной кости) и рассекающий остеохондрит головки плечевой кости, медиального мыщелка плечевой кости и таранной кости (обзор см. в публикациях Siffert107 и Brower7).
В ветеринарии термины «остеохондрит» и «остеохондроз» не применялись до 1960 гг.71 Первые исследования этого состояния были сосредоточены главным образом на поражениях плеча у собак, однако вскоре был введен термин «хронический деформирующий артроз», связанный со «слабостью конечностей», как лучше всего описывающий преобладающие поражения у свиней.73 На основании обширных исследований «слабости конечностей» у свиней Grøndalen32 стр. 37 пришел к заключению, что термином «остеохондроз» следует обозначать «локальные, преимущественно невоспалительные нарушения процесса эндохондрального окостенения в зонах роста и суставном хряще без поверхностных повреждений хряща». Однако в то же время Reiland96 стр. 106 привел следующее утверждение на основании своих обширных исследований: «обнаружено, что остеохондроз у свиней является генерализованным заболеванием, характеризующимся нарушением эндохондрального окостенения». Последнее представление стало общепринятым, приводится во многих учебниках18,88 и относится к поражениям комплекса суставного-эпифизарного хряща и зон роста у многих видов.
Мы соглашаемся, что «остеохондроз» - более подходящий общий термин для описания этого состояния, чем «остеохондрит» в сочетании с определениями (латентный, явный, рассекающий) для обозначения стадии патологического процесса (как обсуждается ниже). Мы считаем остеохондроз (что дословно означает поражение кости и хряща) приемлемым термином для болезни, поражающей хрящевые зоны роста (также называемые энхондральным или эндохондральным хрящом) и препятствующей превращению этой ткани в кость, особенно учитывая длительную традицию и широкое распространение этого термина. Мы не считаем это нарушение генерализованным само по себе, так как типичные поражения при остеохондрозе очаговые по своей природе. Однако у одного индивида может быть несколько очагов остеохондроза, и часто поражения двусторонне-симметричные.
Энхондральное окостенение
В период роста и развития скелета присутствуют две области специализированных хрящевых зон роста на концах длинных костей. Зона роста (или ростовая пластинка) располагается с каждой стороны первичного центра окостенения и ответственна за удлинение. Эпифизарный хрящ, присутствующий между вторичными центрами окостенения и вышележащим суставным хрящом (комплекс суставного и эпифизарного хряща) ответственен за форму концов длинных костей. В обоих участках хрящ зоны роста замещается костью за счет последовательного процесса клеточной пролиферации, синтеза внеклеточного матрикса, гипертрофии клеток, обызвествления матрикса и прорастания сосудов, называемого энхондральным окостенением.70 Преимущество этого процесса заключается в том, что рост и удлинение достигаются путем непрерывного добавления хряща и его последующего замещения костью таким образом, что у индивида сохраняется способность к опоре на протяжении периода роста. Хондроциты в эпифизах и ростовых пластинках организованы в виде четырех зон (рис. 1). Покоящаяся зона содержит нечасто делящиеся хондроциты, функционирующие как предшественники пролиферативной зоны, в которой клетки делятся быстро. В ростовых пластинках пролиферирующие хондроциты образуют легко различимые столбики, в то время как в растущем хряще эпифизов столбчатая организация менее очевидна и клетки образуют скорее скопления, чем столбики (обзор см. в публикации Byers and Brown8). Окончательно дифференцированные гипертрофические хондроциты секретируют и поддерживают высокоспециализированный матрикс, функция которого заключается в ускорении обызвествления хряща, который служит шаблоном для формирования кости остеобластами. В зоне обызвествления остеокласты удаляют поперечные перегородки,69 что позволяет прорастание сосудистых петель и клеток-предшественников остеогенеза в пустоты, занятые гипертрофированными хондроцитами на последней стадии дифференциации. Фактор роста эндотелия сосудов (ФРЭС), образуемый гипертрофическими хондроцитами, по-видимому, является ответственным и необходим для врастания сосудов в зону роста.27 Прорастание сосудов в хрящ необходимо для энхондрального окостенения, поскольку генетическое, биохимическое или механическое нарушение ангиогенеза приводит к утолщению зон роста эпифизов из-за расширения гипертрофической зоны (обзоры см. в публикациях Colnot15 and Hall et al.43).
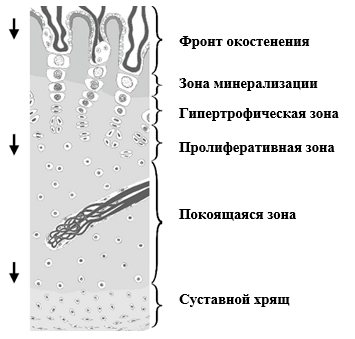
Рис. 1. Схематическое изображение комплекса суставного и эпифизарного хряща в поперечном разрезе, в том числе конца хрящевого канала. Хрящевой канал содержит артериолу, разветвляющуюся на многочисленные капилляры, снова соединяющиеся в венулу. У незрелых животных клетки пролиферативной зоны непрерывно делятся, и клетки гипертрофической зоны увеличиваются в размере, вызывая рост хрящевого комплекса в направлении стрелок. На фронте окостенения сосуды и костные клетки проникают в хрящ в одном направлении. Так как рост хряща немного медленнее продвижения фронта окостенения, хрящевая зона роста становится все тоньше.
В зоне фронта окостенения остеобласты окружают поверхности оставшихся продольных перегородок, которые в гистологических срезах выглядят как обызвествленные хрящевые шипики, и откладывают на них незрелое костное вещество, тем самым формируя первичное губчатое вещество, состоящее из обызвествленного хряща, незрелой костной ткани и пластинчатой кости. Последняя замещает и обызвествленный хрящ, и незрелое костное вещество после его удаления хондрокластами и остеокластического ремоделирования, соответственно.84 Полагают, что скорость, с которой происходит дифференциация и рост, направление процесса в трех измерениях и время завершения процесса зависят от генетических, пищевых, метаболических (в том числе гормональных) и механических факторов. Что касается последнего, описаны компьютерные механобиологические модели хряща,13,14 показывающие, что рост и окостенение хряща усиливаются под действием сдвиговых нагрузок (растягивающих сил) и подавляется гидростатической (сжимающей) нагрузкой.
Несколько исследований (см. обзор в работах Kronenbery63, Provot and Schipani93, Goldring et al.29) доказывают, что пролиферация хондроцитов в зонах роста контролируется по механизму локальной обратной связи, зависимому от временного и пространственного расположения и использующему в основном три сигнальных молекулы, которые синтезируются в хондроцитах: пептид, родственный паратиреоидному гормону (прПТГ), продукт гена семейства Indian hedgehog (IHH) и трансформирующий фактор роста-бета (ТФР-бета). Такой механизм обратной связи регулирует скорость, с которой хондроциты покидают пролиферативную зону и необратимо дифференцируются в конечные гипертрофические клетки.1 прПТГ, пептидный гормон, гомологичный паратиреоидному гормону, синтезируется и секретируется околосуставными клетками перихондрия и хондроцитами на более поздних стадиях развития. Он способствует непрерывной пролиферации хондроцитов в зонах роста и подавляет гипертрофию хондроцитов.56 Таким образом, поддерживается определенный объем пролиферирующих клеток и предотвращается преждевременная дифференциация в прегипертрофические и гипертрофические хондроциты (рассматривается в публикации Goldring et al.29). IHH, лиганд из семейства hedgehog, связанный с клеточной поверхностью – секретируемая молекула, образуемая прегипертрофическими и гипертрофическими хондроцитами, которая способствует пролиферации хондроцитов и дает сигнал к поддержанию экспрессии прПТГ на концах развивающейся кости.106 За счет подавления созревания хондроцитов брПТГ дезактивирует IHH в клетках вблизи концов кости.106 Полагают, что Runx2, фактор транскрипции, экспрессирующийся в хондроцитах при инициации гипертрофии, координирует соответствующую скорость созревания и пролиферации хондроцитов, активируя IHH и, соответственно, прПТГ (обзор Provot and Schipani93). ТФР-бета образуется клетками перихондрия в ответ на IHH и действует на клетки перихондрия и околосуставных тканей, усиливая синтез прПТГ (обзор Ballock and O’Keefe1). Кроме того, ТФР-бета способен действовать непосредственно на хондроциты и подавлять гипертрофию. Хотя этот механизм обратной связи с участием прПТГ–IHH–ТФР-бета, по-видимому, является основным регулятором клеточной пролиферации в зонах роста, также вероятно, что эта регулирующая сеть модулируется другими системными и локальными сигнальными молекулами.1,63,93
Хрящевые каналы
Хотя хрящевой матрикс в эпифизарных зонах роста макроскопически неотличим от матрикса вышележащего суставного хряща, он отличается наличием сосудов, прорастающих в хрящ из окружающего перихондрального сплетения75 и проходящих в каналах, называемых хрящевыми каналами, в то время как суставной хрящ не содержит сосудов (рис. 2)104; эти различия обнаружены гистологически и в исследованиях с перфузией/просветлением тканей. Хрящевые каналы также присутствуют в хрящевых зонах роста, в которые входят со стороны эпифиза, и подробно описаны как у млекопитающих,25,59,72,105,113,127 так и у птиц.75 В наиболее сложной форме сосудистые структуры состоят из артериолы, разветвляющейся на сеть капилляров, иногда напоминающую клубочковую сеть почек (рис. 1). Капилляры проходят вдоль артериолы и снова соединяются в одну венулу, идущую параллельно артериоле назад в перихондральное сплетение.46 В хряще зон роста видны анастомозы между хрящевыми каналами.125 Однако хрящевые каналы могут входить в нижележащую кость, где образуют анастомозы с сосудами в костном мозге.46,136 Функции хрящевых каналов поняты не до конца, однако предполагают, что они служат трем целям: 1) питание хондроцитов в зонах, недосягаемых для диффундирующих питательных веществ из синовиальной жидкости,46,127,132 2) роль в формировании и поддержании вторичных центров окостенения124,132 и 3) доставка мезенхимных стволовых клеток в хрящ и кость.42,64,126
По мере роста индивида скорость роста хряща снижается по сравнению со скоростью продвижения фронта окостенения, таким образом, последний движется к суставному хрящу, делая хрящевую зону роста все тоньше (рис. 1). Одновременно хрящевые каналы претерпевают процесс физиологического регресса, известный как хондрификация.42 Этот термин обозначает преобразование хрящевого канала, в процессе которого находящиеся в нем сосуды регрессируют, а мезенхимные клетки превращаются в пролиферирующие и образующие матрикс хондроциты, заполняющие просвет бывшего канала.42,113 Такое превращение не оказывает отрицательного влияния на соседний хрящ. К достижению взрослого возраста хрящевые зоны роста на эпифизах замещаются костью и хрящевых каналов не остается.
Проявления остеохондроза
Основное патологическое изменение при остеохондрозе суставов и зон роста заключается в локальном нарушении энхондрального окостенения; то есть в хрящевой зоне роста не происходит минерализации матрикса или прорастания сосудов, и (таким образом) она не превращается в кость.19 Макроскопически на срезах это имеет вид локальной обширной зоны утолщенного хряща с неравномерной/беспорядочной границей между хрящом и костью. В случаях более поздней стадии остающийся хрящ мягкий и красноватого цвета, а нижележащий костный мозг отечный и гиперемичный. Однако до того как локальное нарушение энхондрального окостенения разовьется и станет видимым макроскопически, при остеохондрозе суставов уже присутствуют гистологические изменения в виде ограниченной зоны некроза, не выходящей за пределы хрящевых зон роста и не распространяющейся в вышележащий суставной хрящ или нижележащую подхрящевую кость (рис. 3). В наших предыдущих исследованиях мы обозначили наличие очага некроза хряща, ограниченного эпифизарным хрящом, как латентный остеохондроз (osteochondrosis latens), а наличие очагового нарушения энхондрального окостенения, видимого макроскопически и на рентгеновских снимках, – как явный остеохондроз (osteochondrosis manifesta) (рис. 4).135 После формирования трещины в зоне некротического хряща и ее распространения сквозь суставной хрящ (хондромное или свободное тело) заболевание следует считать рассекающим остеохондрозом (РОХ) (osteochondrosis dissecans).
У свиней типичные поражения при суставном остеохондрозе обнаруживаются в медиальной части и сагиттальном гребне дистального мыщелка плечевой кости, а также медиальном мыщелке бедренной кости. Кроме того, поражения, классифицируемые как остеохондроз, часто обнаруживаются в полулунной вырезке локтевой кости и в дистальной зоне роста локтевой кости. Реже они обнаруживаются в плечевом, тазобедренном и скакательном суставах, бугристости-апофизе седалищной кости, соединениях позвонков и хрящевых соединениях ребер (обзор см. в работе Nakano et al.82).
У одного животного может быть несколько очагов, часто симметричных. Однако генерализованное распределение с поражением гиалинового хряща в местах, отличающихся от указанных выше предпочтительных зон поражения, считается редким. Jørgensen et al.55 и Jørgensen and Andersen54 пришли к заключению о низкой или незначимой корреляции между развитием остеохондроза в разных частях тела (часто симметричным), таким образом, остеохондроз, по крайней мере у свиней, не является генерализованным заболеванием. Основные изменения при остеохондрозе свиней часто наблюдаются к 2-месячному возрасту; описаны случаи их появления уже через 2 недели после рождения.48 Клинические признаки хромоты обычно не очевидны в этом возрасте и наиболее распространены у молодняка (4-18 месяцев).18
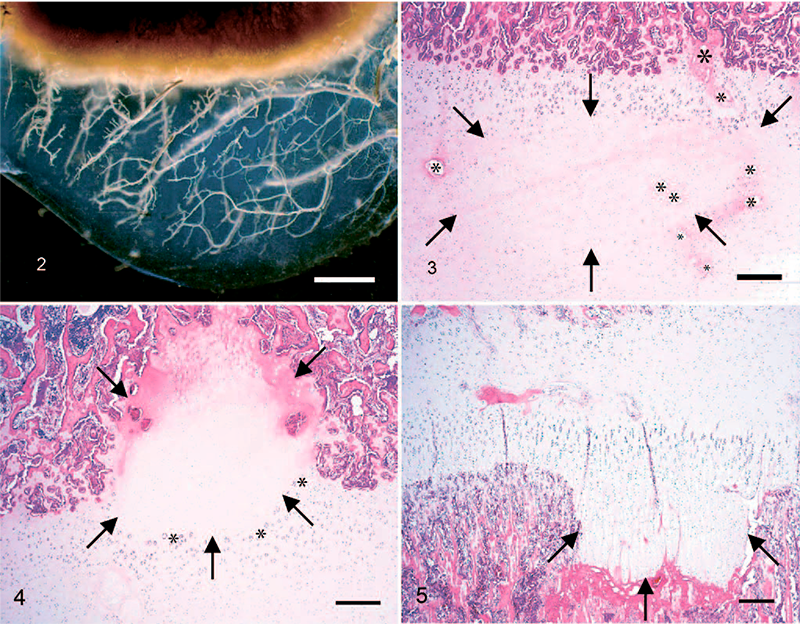
Рис. 2. Хрящевые каналы в комплексе суставного и эпифизарного хряща медиального мыщелка бедренной кости 7-недельного поросенка, вид при трансиллюминации. Это изображение переднего фрагмента толщиной 5 мм, взятого у животного при перфузии сульфатом бария, для просветления тканей использовали метилсалицилат (полное описание см. в работе Ytrehus134). Хрящ в эпифизарной зоне роста содержит много сосудов, хрящевые каналы ветвятся от абаксиальной (справа) до аксиальной (слева) надхрящницы, в то время как суставной хрящ (нижняя часть) не содержит сосудов. Длиналинии 2 мм.
Рис. 3. Микроскопический срез медиального мыщелка бедренной кости 16-недельной свиньи с поражением, характерным для латентного остеохондроза. В покоящейся зоне присутствует крупная область некроза хряща (стрелки), внутри которой находятся некротические хрящевые каналы (звездочки). Окрашивание гематоксилином и эозином, длина лини 50 мкм.
Рис. 4. Микроскопический срез медиального мыщелка бедренной кости 16-недельной свиньи с поражением, характерным для явного остеохондроза. Зона некроза хряща (стрелки) частично окружена подхрящевой костью. На границе между некротическим и живым хрящом присутствуют хондроциты в виде скоплений (звездочки). Длиналинии 50 мкм.
Рис. 5. Микроскопическийсрездистальнойчастилоктевойкости 20-недельнойсвиньи. Остеохондроз зон роста характеризуется сохранением гипертрофических хондроцитов (стрелки) в костном веществе метафиза. Окрашивание гематоксилином и эозином. Длина линии 100 мкм.
У собак остеохондроз суставов часто поражает каудальную центральную часть головки плечевой кости, медиальную часть дистального мыщелка плечевой кости, медиальный и латеральный дистальные мыщелки бедренной кости и медиальный и латеральный гребни блока таранной кости. Кроме того, поражения дистальной зоны роста локтевой кости и крестцовой кости часто описывают как остеохондроз.77 Собаки среднего и крупного размера болеют чаще, чем более мелкие, а кобели – чаще сук. Кроме того, у определенных пород чаще наблюдается остеохондроз со специфической локализацией.71
У лошадей остеохондроз считается распространенной причиной хромоты молодых спортивных животных.76 Например, Grøndahl and Dolvik31 при обзоре рентгеновских снимков молодых рысаков породы стандартбред оценили распространенность РОХ тибиотарзального сустава как 14,3%. К сожалению, термины «остеохондроз» и «рассекающий остеохондроз» применительно к лошадям используются чрезмерно и без разбора для обозначения различных поражений скелета незрелых животных , а в некоторых случаях и взрослых лошадей без учета различий в этиологии, патогенезе и клинических характеристиках.92 Повреждения каудальной части проксимальной суставной поверхности плечевой кости, медиальной части мыщелка плечевой кости, латерального гребня плечевой кости, медиального мыщелка плечевой кости, промежуточного гребня дистальной части большеберцовой кости, латерального гребня блока таранной кости и дорсальной части дистальных частей пясти и плюсны относят к остеохондрозу правильно.76,92
У людей к остеохондрозам относят более 50 синдромов (большинство из них носят эпонимические названия) с поражением разной локализации.107,109 Суставной остеохондроз с поражением преимущественно суставного хряща и эпифизов, по-видимому, сходен с суставным остеохондрозом у свиней. Однако, как указано Bohndorf,5 ход развития РОХ invivo и его патолого-анатомические корреляции у людей выяснены не полностью. Причина этого заключается в том, что единственной тканью, доступной для исследований, являются фрагменты и свободные тела, обнаруживающиеся при хирургическом вмешательстве у индивидов с клиническими симптомами заболевания. Это в основном соответствует конечной стадии заболевания; данные гистологического исследования ранних (субклинических) поражений при РОХ недоступны.
В связи с недостаточно последовательной классификацией и отсутствием знаний о ранних проявлениях заболевания различной локализации, данные о заболевании у людей нельзя легко перенести на животных (и наоборот). Однако возрастное распределение пациентов, а также расположение, макроскопическая и рентгенографическая картина поражений при рассекающем остеохондрите дистального, медиального и латерального мыщелков бедренной кости; медиальной части гребня таранной кости и дистального мыщелка плечевой кости у людей, по-видимому, во многом сходны с остеохондрозом в соответствующей локализации у животных.5,99,100 Фактически, еще в 1978 г Sten-Erik Olsson86 предположил, что патологическая физиология остеохондроза по существу одинакова у всех видов, в том числе человека.
Ни Grøndalen37, ни Reiland96 не описали какой-либо окончательной номенклатуры для дифференциации между поражениями комплекса суставного-эпифизарного хряща и хрящевых зон роста. Однако в то время как основные поражения комплекса суставного-эпифизарного хряща характеризуются некрозом хряща,9,12,22 преобладающей морфологической особенностью поражений хрящевых зон роста является сохранение хондроцитов с гипертрофической морфологией (рис. 5).49 Нарушение энхондрального окостенения при остеохондрозе суставов происходит вследствие некроза хряща, в то время как в хрящевых зонах роста это, по-видимому, обусловлено изменениями в развитии гипертрофических хондроцитов.
Хотя этот обзор посвящен суставному остеохондрозу, необходимы некоторые комментарии относительно патогенеза поражения зон роста. Существует две гипотетические сосудистые модели, которые могли бы объяснить, каким образом формируются поражения в этой области. Первая подтверждается результатами недавнего исследования на птицах, показавшего, что экспериментально индуцированный апоптоз эндотелиальной выстилки сосудов хрящевого канала и, соответственно, окружающих хондроцитов, инициирует дисхондроплазию большеберцовой кости,95 заболевание, морфологически во многом сходное с остеохондрозом зон роста у млекопитающих.19,116 Гипотетически - локальное прекращение кровоснабжения хрящевого канала в зонах роста с последующей гибелью хондроцитов, ближайших к метафизу (где ишемия предположительно тяжелее), должно привести к образованию пластинки из аномального матрикса, препятствующей росту метафизарных сосудов после того, как до нее дойдет фронт окостенения (рис. 6). Такая пластинка должна действовать как барьер для проникновения сосудов в нормальный матрикс, в последующем образуемый хондроцитами, ближайшими к эпифизу, что приводит к сохранению гипертрофических хондроцитов и формированию массы утолщенного эпифизарного хряща в пораженной зоне. Исследования с перфузией и гистологической оценкой в случаях спонтанно развившейся дисхондроплазии, проведенные Thorp and Duff,115 дополнительно подтверждают эту теорию. Авторы предположили, что закрытие эпифизарных хрящевых каналов приводит к образованию полосы аномального хряща, препятствующего прорастанию метафизарных сосудов. Альтернативно - прекращение кровоснабжения фронта окостенения может быть обусловлено микротравмой сосудов метафиза, приводящей к нарушению конечной дифференциации гипертрофического хряща и, следовательно, сохранению утолщенного эпифизарного хряща (рис. 6). Эта теория подтверждается исследованиями, показывающими, что 1) хирургическое прекращение кровотока в метафизарных сосудах у фронта окостенения вызывает поражения, характерные для дисхондоплазии большеберцовой кости у птиц,98 2) прекращение кровотока в метафизарных сосудах путем пережатия приводит к сохранению конусов гипертрфической хрящевой ткани в ростовых пластинках кроликов118 и 3) перегрузки приводят к формированию очагов остеохондроза в дистальной зоне роста у свиней.39 Является ли начальной стадией патогенеза остеохондроза зон роста нарушение кровоснабжения хряща глубокой покоящейся зоны ростовых пластинок через хрящевой канал или нарушение притока крови к фронту окостенения по метафизарным сосудам – предмет дальнейших исследований. В оставшейся части этого обзора мы сосредоточимся на поражениях комплекса суставного и эпифизарного хряща, так как большинство недавних научных работ посвящено именно им.
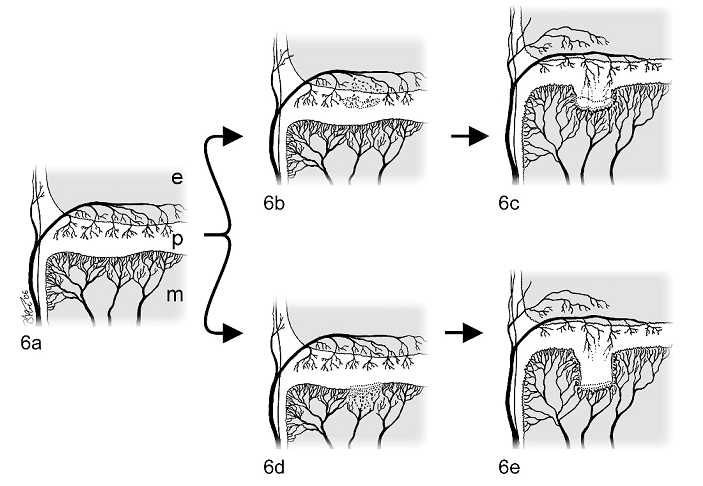
Рис. 6. Гипотетические модели патогенеза остеохондроза зон роста. Схематические изображения срезов ростовой пластинки на разных стадиях. Область ростовой пластинки (р), ближайшая к эпифизу, кровоснабжается с помощью хрящевых каналов, проникающих в нее из эпифизарного костного мозга (е). Область ростовой пластинки, ближайшая к метафизу (m), в значительной степени лишена сосудов, однако в нее прорастают сосуды продвигающегося фронта окостенения (рис. 6a). Один из возможных механизмов патогенеза, показанных на рис. 6bи 6c, заключается в локальном прекращении кровоснабжения ростовой пластинки через хрящевой канал и ишемическом некрозе узкой зоны хряща (показанной точечной линией на рис. 6b). По мере роста кости в направлении эпифиза фронт достигает аномального хряща, препятствующего прорастанию кровеносных сосудов и нормальному окостенению жизнеспособного хряща выше (рис. 6c). Еще одна модель, показанная на рис. 6dи 6e, заключается в локальном прекращении кровоснабжения через метафизарные сосуды, доставляющие кровь к фронту окостенения (зона, обозначенная точечной линией на рис. 6d), на первой стадии заболевания. Отсутствие прорастания сосудов в последующем мешает нормальному процессу окостенения жизнеспособного хряща над дефектом (рис. 6e).
Предложенные этиологии остеохондроза
Этиология остеохондроза считается многофакторной, и единственного фактора, ответственного за все аспекты заболевания, не существует.19,100 Предполагаемые факторы, играющие роль в этом заболевании, включают быстрый рост, наследственность, анатомические особенности, травму, пищевые факторы и нарушение кровоснабжения эпифизарного хряща (подробнее обсуждается ниже).
Быстрый рост
Повышение распространенности слабости конечностей у свиней в середине 20 столетия совпало с резким ускорением роста этих животных, что приписывают главным образом усилению экономического давления и потребностью сократить период от рождения до убоя. Таким образом, логично предположить, что быстрый набор веса в результате усиленного кормления или наследственности может стать значимым предрасполагающим фактором развития остеохондроза. Однако на протяжении многих лет опубликовано лишь несколько работ, поддерживающих эту точку зрения (обзор см. в публикациях Nakano82 и Ekman and Carlson19). О том, что быстрый рост не является центральным фактором развития остеохондроза, свидетельствует отсутствие значительных изменений распространенности поражений при замедлении роста путем ограниченного кормления.11,34,81,128 Кроме того, животные с генетически более медленной скоростью роста могут страдать от остеохондроза не реже.121 Однако некоторые крупные популяционные обзоры показали положительную генетическую корреляцию между быстрым ростом и распространенностью остеохондроза.54,74
В нашем недавнем исследовании 1690 потомков 15 хряков, выращенных в одном стаде с одинаковыми условиями, не удалось показать какой-либо корреляции между убойным весом или скоростью роста с рождения до убоя и распространенностью поражений, связанных с явным или рассекающим остеохондрозом.135 Сходным образом в другом исследовании мы не обнаружили связи между скоростью роста, весом и изменениями, связанными с латентным остеохондрозом, у 48 поросят.134
Однако Lundeheim74 отметил, что свиньи с клиническими признаками слабости конечностей при убое росли быстрее на ранних стадиях жизни, чем свиньи без этих признаков, но ко времени убоя их рост стал медленнее. Он предположил, что неблагоприятное соотношение между упитанностью и скоростью роста уравновешивается дискомфортом из-за появляющихся клинических признаков слабости конечностей, приводящим к снижению потребления корма.
Сообщалось, что быстрый рост собак повышает риск заболеваний скелета, в том числе остеохондроза.97 Авторы, поддерживающие это утверждение, часто цитируют исследования Hedhammar et al.47 В этих исследованиях 24 догов кормили неограниченно или ограниченно кормом, богатым белком, энергией, кальцием и фосфором. За каждыми двумя животными на каждом режиме кормления наблюдали в течение 9, 12, 24, 36, 48 и 60 недель, после чего их умерщвляли и проводили вскрытие. Основными патологическими изменениями в этом исследовании были относительное нарушение созревания хряща и резорбция кости в группе, получавшей корм неограниченно, по сравнению с группой ограниченного кормления, что было приписано постоянному относительному повышению концентраций кальцитонина и паратиреоидного гормона в крови. Остеохондроз суставов обнаружен всего у 5 собак; у 3 из них (все подверглись эутаназии через 24 недели: 2 в группе ограниченного и 1 в группе неограниченного кормления) обнаружено двухстороннее поражение головки плечевой кости,131 в то время как у двух других (эутаназия через 48 недель: 1 из группы ограниченного и 1 из группы неограниченного кормления) обнаружены поражения суставных отростков шейных позвонков.17 Тот факт, что число пораженных животных в группах неограниченного и ограниченного кормления было почти равным, не подтверждает гипотезу о повышении частоты остеохондроза при быстром росте у собак.
Предполагалось, что повышение концентрации инсулина и снижение тироксина в крови лошадей, обусловленное рационами высокой калорийности, может привести к нарушению созревания и гипертрофии хондроцитов, наиболее доступных для воздействия гормонов, циркулирующих в крови; в частности, это относится к хондроцитам, окружающим хрящевые каналы.52,105 Согласно этой гипотезе, хондроциты под влиянием повышенной концентрации инсулина и сниженной концентрации тироксина сохраняются в виде хрящевых ядер. В последующем эти ядра становятся некротическими под действием биомеханических факторов в переходной зоне между хрящом и костью,52 образуя очаги, сходные с остеохондрозом у свиней. Однако этим теориям противоречат данные о морфологии первичных повреждений при суставном остеохондрозе, характеризующихся четко отграниченными областями некроза хондроцитов в эпифизарном хряще.9 Формирование хрящевых ядер – последующее явление, вызванное стойкостью некротического хряща к процессам минерализации и васкуляризации. Эта теория также не учитывает тот факт, что поражения возникают локально в определенных характерных местах, а не являются генерализованными.
Таким образом, большинство опубликованных в литературе данных по всем видам животных не подтверждает непосредственной роли усиления скорости роста/чрезмерного кормления в этиологии остеохондроза.
Наследственность
Различия в распространенности остеохондроза между разными породами и племенными линиями свиней,33,40,54,122 собак66 и лошадей31 с высокой вероятностью говорят о наследственном компоненте остеохондроза. Однако оценки наследуемости этого заболевания сильно варьируются, например у свиней от 0,09 до 0,46 для мыщелка плечевой кости и от 0,20 до 0,49 для мыщелков бедренной кости.54,112,133 Многие авторы предполагали, что наследственный фактор тесно связан с предрасположенностью к повышению скорости роста; однако как упоминалось ранее, имеющиеся данные о связи между остеохондрозом и быстрым ростом противоречивы.11,34,80,128 В нашем недавнем исследовании на остеохондроз потомства 15 хряков высокой племенной ценности обнаружено, что наследственные факторы значительно влияют на распространенность, тяжесть и локализацию остеохондроза,135 однако корреляции между быстрым ростом и поражениями вследствие остеохондроза нет. Вместо этого предполагалось, что важным наследственным фактором у свиней может быть анатомическая конформация (см. ниже).136 Это также предполагалось в случаях отрыва бугристости большеберцовой кости у определенных пород собак – состояния, которое может быть результатом остеохондроза зон роста.108
Все исследования наследуемости у лошадей указывают на полигенный механизм наследования остеохондроза,91 и сходные результаты получены в исследованиях на собаках.87 Все еще предстоит выяснить, какие наследственные черты предрасполагают к развитию заболевания, а также природу взаимодействий между факторами окружающей среды и генетическими факторами. Доказательства роли генетики в заболеваниях людей, относимых к остеохондрозу, представлены в публикациях о клинических случаях двухсторонней болезни Кёлера,120 инфаркта Фрайберга4 и болезни Шейерманна,30,41 иногда с одновременным возникновением и параллельным клиническим течением у идентичных близнецов.
Таким образом, для всех исследованных видов получены убедительные доказательства значимости наследственности в этиологии остеохондроза. Следует отметить, что все эти исследования были сосредоточены на поздних стадиях болезни (первичный рассекающий остеохондроз). Возможно, при исследовании на ранних стадиях поражения (латентный остеохондроз) связи были бы другими, так как при этом менее вероятны осложнения в результате факторов, связанных с длительным прогрессированием болезни.
Анатомические особенности
Согласно Schenck,100 еще в 1933 г медицинский хирург Файрбанк предположил, что многократные соударения межмыщелкового возвышения большеберцовой кости и латеральной поверхности медиального мыщелка бедренной кости при вращении большеберцовой кости внутрь – этиологический фактор рассекающего остеохондрита коленного сустава у людей. Smillie110 подтвердил это предположение в своей обширной работе и пришел к заключению, что частота рассекающего остеохондрита зависит от анатомической формы и функции коленного сустава человека. Grøndalen37 измерил 29 характеристики формы скелета, оценил макроскопические изменения и внешнюю конформацию 912 убойных и племенных свиней. Он предположил связь между внешними особенностями, формой сустава и поражениями сустава и заявил, что локальные перегрузки вследствие неблагоприятной формы сустава является значимой причиной явного и рассекающего остеохондроза.33,36 Кроме того, он заключил, что наследственные особенности, определяющие определенную форму и внешнюю конформацию сустава, обусловливают разную тяжесть поражения суставов в разных пометах.35 Эти заключения подтверждаются работой van der Wal et al.,122 обнаруживших, что длина туши и относительный вес окорока значительно коррелируют со степенью поражения проксимальных и дистальных частей бедренной кости остеохондрозом. На основании этих данных Grøndalen37 предложил критерии селекции, основанные на форме и внешней конформации суставов. Некоторые из этих критериев были внедрены в норвежскую систему свиноводства с 1974 г. По данным сравнительных обзоров, проведенных в 1970 и 1980 гг, частота тяжелых поражений (рассекающего остеохондроза) коленного сустава снизилась с 6,7 до 1,5%.38
На основании результатов вскрытия Olsson85 предположил, что локальные травмы, которые могут варьироваться в зависимости от сустава, имеют большое значение в этиологии остеохондроза у собак. Он пришел к заключению, что многократные микротравмы вследствие, например, соударений дорсокаудальной части головки плечевой кости в плечевом суставе и форсированный контакт между медиальной поверхностью латерального мыщелка бедренной кости и латеральной частью межмыщелкового возвышения в коленном суставе – важные факторы распространенности заболевания.
Таким образом, анатомические особенности, по-видимому, важны для этиологии остеохондроза; однако несомненно, что они обусловлены (по меньшей мере в некоторой степени) генетикой. Так как анатомические характеристики сложно измерить последовательно и они изменяются по мере прогрессирования заболевания, определить их точный вклад затруднительно.
Травма
Травма – одна из наиболее частых предполагаемых причин остеохондроза у всех видов животных (обзор см. в работе Bohndorf5 and Ekman and Carlson19). В пользу травматической этиологии говорит то, что места предпочтительного поражения у всех видов животных обычно представляют собой участки локальных биомеханических нагрузок. Кроме того, усиленные нагрузки (например, повышенные спортивные нагрузки у людей),5 по-видимому, повышают распространенность и тяжесть макроскопичеких поражений при остеохондрозе. Экспериментальные исследования также дали доказательства роли травмы. Nakano and Aherne79 обнаружили, что свиньи, падавшие с разной высоты (<1 м) в молодом возрасте (средний вес: 29 кг), имели больше поражений, характерных для рассекающего остеохондрита, при убое (средний вес: 90 кг), чем в контрольной группе однопометников, выращенных в остальном сходных условиях.
Роль травмы в патогенезе остеохондроза может зависеть от стадии болезни. Хотя травма может способствовать переходу субклинического явного остеохондроза в рассекающий остеохондроз, обычно для этого достаточно лишь минимальной травмы, часто обусловленной только силами, действующими при нормальном передвижении. Фактически возникновение клинических признаков в большинстве случаев остеохондроза, возможно, провоцируется каким-то типом травмы, которая обычно незначительна или (по меньшей мере) недостаточно тяжела, чтобы вызвать заболевание сустава в остальном нормального. Тем не менее четких доказательств роли острой макротравмы в инициации первичных поражений при остеохондрозе нет.
Таким образом, хотя известно, что значительная травма способна вызвать переломы при остеохондрозе, особенно у людей, ее роль в начальном развитии остеохондроза, по-видимому, ограничена, о чем свидетельствует отсутствие единичных травматических событий в анамнезе большинства животных и людей.4,19,90,99 Кроме того, значительная травма сама по себе не может объяснить возникновения поражений определенной локализации и их частую симметричность.
Пищевые факторы
Дисбаланс кальциево-фосфорных добавок, недостаточность меди, чрезмерное потребление цинка, недостаточность витаминов С, А, D, биотина и хронический метаболический ацидоз – исследованные предполагаемые этиологические факторы остеохондроза (обзор работ, посвященных свиньям, см. в Nakano et al.82). Однако эксперименты с дополнением рациона минеральными веществами и витаминами, недостаточность которых подозревалась, либо добавка бикарбоната натрия для противодействия предполагаемому метаболическому ацидозу значительно не повлияли на распространенность и/или тяжесть остеохондроза у свиней.82
В исследовании влияния рациона на развитие скелета собак диета с высоким содержанием кальция вызывала изменения, типичные для рахита, которые исчезали после нормализации поступления кальция. У собак во всех трех группах (контрольной, на рационе с высоким содержанием кальция и высоким содержанием кальция+фосфора) обнаружены локальные задержки эндохондрального окостенения костно-хрящевых соединений ребер, тяжесть которых, по-видимому, не зависела от группы.101 В другом исследовании, в котором собакам давали корм с высоким содержанием витамина D3 или контрольный рацион, обнаружены неравномерности в зонах роста ребер в обеих группах, при этом указывалось, что в группе, получавшей много витамина D3, поражения были тяжелее; однако количественной оценки поражений не проводили.119
У нескольких видов, включая оленя,44,114 бизона130 и лошадей,51,60 отмечена связь суставного остеохондроза с недостаточностью меди. Поражения вызываются либо первичной недостаточностью меди, либо воздействием веществ, подавляющих ее всасывание и метаболизм (например, цинк, кадмий или неорганические сульфаты ).62,114 Предполагается, что добавка меди кобылам на поздней стадии жеребости защищает потомство от остеохондроза89; однако Gee et al.26 не обнаружили влияния добавки Cu в рацион кобыл на концентрацию меди в печени жеребят или частоту неравномерности структуры хряща. Поражения, наблюдаемые в связи с низкой концентрацией меди в сыворотке и/или печени, обычно тяжелые, обширные и распространяются на несколько суставов. Таким образом, эти поражения нетипичны для спонтанно развившегося остеохондроза, но более сходны с признаками недостаточности меди у крупного рогатого скота.51 В подтверждение этого предположения Pool утверждает, что индуцированный недостаточностью цинка или меди остеохондроз у лошадей может быть отдельной нозологической единицей, отличной от остеохондроза.92 Последнее и, возможно, самое важное - недостаточность меди – системное нарушение, в то время как остеохондроз ограничен растущим хрящом.
Таким образом, исследования, в которых изучалась зависимость между пищевыми факторами и остеохондрозом, не смогли показать веских доказательств такой связи.82 В целом в имеющейся на сегодня литературе, посвященной этиологическим факторам остеохондроза, приводятся относительно веские доказательства роли генетических и анатомических особенностей в этиологии этого заболевания, в то время как доказательств роли быстрого роста, значительных травм или пищевых факторов нет или очень мало.19,134–136
Модели патогенеза остеохондроза
Хрупкость хряща и (или) кости
Grøndalen37 предположил, что «слабая хрящевая/костная ткань» может быть одной из основных причин слабости конечностей у свиней и что основными причинами слабости могут быть генетические состояния и (или) пищевые факторы. В обзоре, основанном на исследованиях догов, Dämmrich16 предположил, что из-за избыточного питания и ускоренного роста относительная остеопения подхрящевой костной ткани приводит к ослаблению биомеханической поддержки вышележащего хряща костью, приводя к нарушению метаболизма хондроцитов и остеохондрозу.
При исследовании лошадей, получающих корм с очень низким содержанием меди, Hurtig et al.51 обнаружили, что у жеребят с поражениями суставов отсутствовали поперечные связи между группами дигидроксилизина в соседних коллагеновых волокнах хряща и кости, возможно, из-за недостаточности зависимого от меди фермента лизилоксидазы. Помимо прочего, повреждения у лошадей и бизонов с недостаточностью меди характеризовались микропереломами костных шипиков в подхрящевой кости, сниженным формированием первичного губчатого вещества и истончением/эрозией суставного хряща.51,130 Таким образом, Hurtig et al.51 предположили связь между низким поступлением меди в организм быстрорастущих лошадей, низким качеством коллагена, биомеханически слабым хрящом и костью и поражениями, характерными для рассекающего остеохондроза.
Как упоминалось ранее, в связи с очаговой природой поражений при остеохондрозе маловероятно, что это заболевание вызвано генерализованной слабостью хряща или кости самой по себе. С другой стороны, теоретически возможно, что биомеханически слабые ткани (по ряду причин) не в состоянии обеспечить поддержку кровеносных сосудов в хряще и/или кости, тем самым снижая порог сосудистых повреждений и индуцируя ишемический некроз хряща в зонах роста (см. ниже). Однако учитывая морфологию поражений, их высокую распространенность у здоровых в остальном животных и тот факт, что поражаются четко определенные участки и относительно малое число состояний, связанных с ослаблением хряща и кости, маловероятно, что формирование хрупкой поддерживающей ткани играет основную роль в патогенезе остеохондроза.
Первичная дисхондроплазия
Olsson and Reiland86 предположили, что остеохондроз может начаться как генерализованное нарушение развития и созревания хондроцитов (т. е. дисхондроплазия), приводящее к многоочаговому изменению энхондрального окостенения. Ekman and Heinegård20 предположили, что самым ранним изменением при остеохондрозе может быть изменение фенотипа хондроцитов, приводящее к последующим изменениям синтеза и сборки матрикса по сравнению с нормальным хрящом. Причина фенотипического изменения не была установлена, однако согласно одному из предположений, оно возникало на фоне ишемии, вызванной некрозом сосудистых каналов.20,21 Эти первичные повреждения должны препятствовать процессу окостенения и в конечном итоге превращаться в персистирующий хрящ, подверженный дальнейшим повреждениям внутри сустава. Эти авторы дополнительно предположили, что вторичные изменения в виде некроза хряща (остеохондроз) возможны в результате биомеханических нагрузок.52 Однако эта модель не учитывает несколько важных особенностей остеохондроза, включая тот факт, что поражения развиваются в определенных предпочтительных местах, различающихся у разных видов, а также тенденцию к двухсторонней симметричности. По нашему мнению, морфологических доказательств теории развития остеохондроза в результате генерализованного нарушения развития/созревания хряща не существует.
Некроз подхрящевой кости
Первичное поражение при остеохондрозе в медицинской литературе часто интерпретируется как некроз подхрящевой кости99,123 с вторичным поражением вышележащего хряща.5 Согласно Nagura,78 Ludoff в 1908 предположил, что некроз вызван травмой сосудов, снабжающих кость кровью. Далее Smillie110 пришел к заключению, что основная патология рассекающего остеохондрита, развивающегося как в детском, так и во взрослом возрасте, заключается в локальной ишемии, относительной или абсолютной. Для подтверждении теории о некрозе подхрящевой кости в качестве первичного повреждения при остеохондрозе широко используются такие доказательства, как присутствие некротической и жизнеспособной кости в удаленных хирургически костно-хрящевых фрагментах или свободных телах. Однако, как показали Bravo et al.,6 хирургическое формирование хрящевого свободного фрагмента может вызвать рост хрящевых каналов и формирование дополнительного центра окостенения, что приводит к появлению компонента из губчатой кости во фрагменте, ранее состоявшем только из хряща. Недостаточное кровоснабжение новообразованного центра окостенения (возможно, в результате движений фрагмента) может в последующем привести к некрозу кости. Таким образом, обнаружение некротической губчатой кости в костно-хрящевых фрагментах или свободных телах, удаленных при операции, не доказывает происхождения из очага первичного некроза кости. Кроме того, теория об ишемическом некрозе подхрящевой кости как первичном повреждении при остеохондрозе не подтверждается ветеринарной литературой, где для исследования доступны ранние субклинические повреждения.19
Ишемический некроз хряща в зонах роста
Исследования спонтанного остеохондроза у свиней10,59,129 показали, что ранние (субклинические) повреждения (латентный и явный остеохондроз) характеризуются зонами некроза хряща, тесно связанными с некротическими и не переносящими кровь сосудами в хрящевых каналах. Кроме того, показано, что такие повреждения возникают в очень предсказуемых и зависимых от возраста участках в дистальной части плеча, и эти зоны напрямую связаны с возрастным ухудшением кровоснабжения.12,134 Также в экспериментальных исследованиях, в которых островки хряща лишали кровоснабжении, образовывались повреждения, сходные с ранней стадией остеохондроза.12 В частности, учитывая отсутствие доказательств непосредственного повреждения кровеносных сосудов хрящевого канала, Carlson et al.12 предположили на основании этих данных, что рост хряща у свиней настолько быстрый, что нарушает нормальный процесс хондрификации, приводя к некрозу сосудов хрящевых каналов и соседнего хряща в зонах роста. Ekman and Carlson19 предположили, что локальная ишемия на фоне дефектов кровоснабжения через хрящевой канал ведет к формированию уязвимых зон некротического эпифизарного хряща, что в последствии приводит к очаговому нарушению энхондрального окостенения.
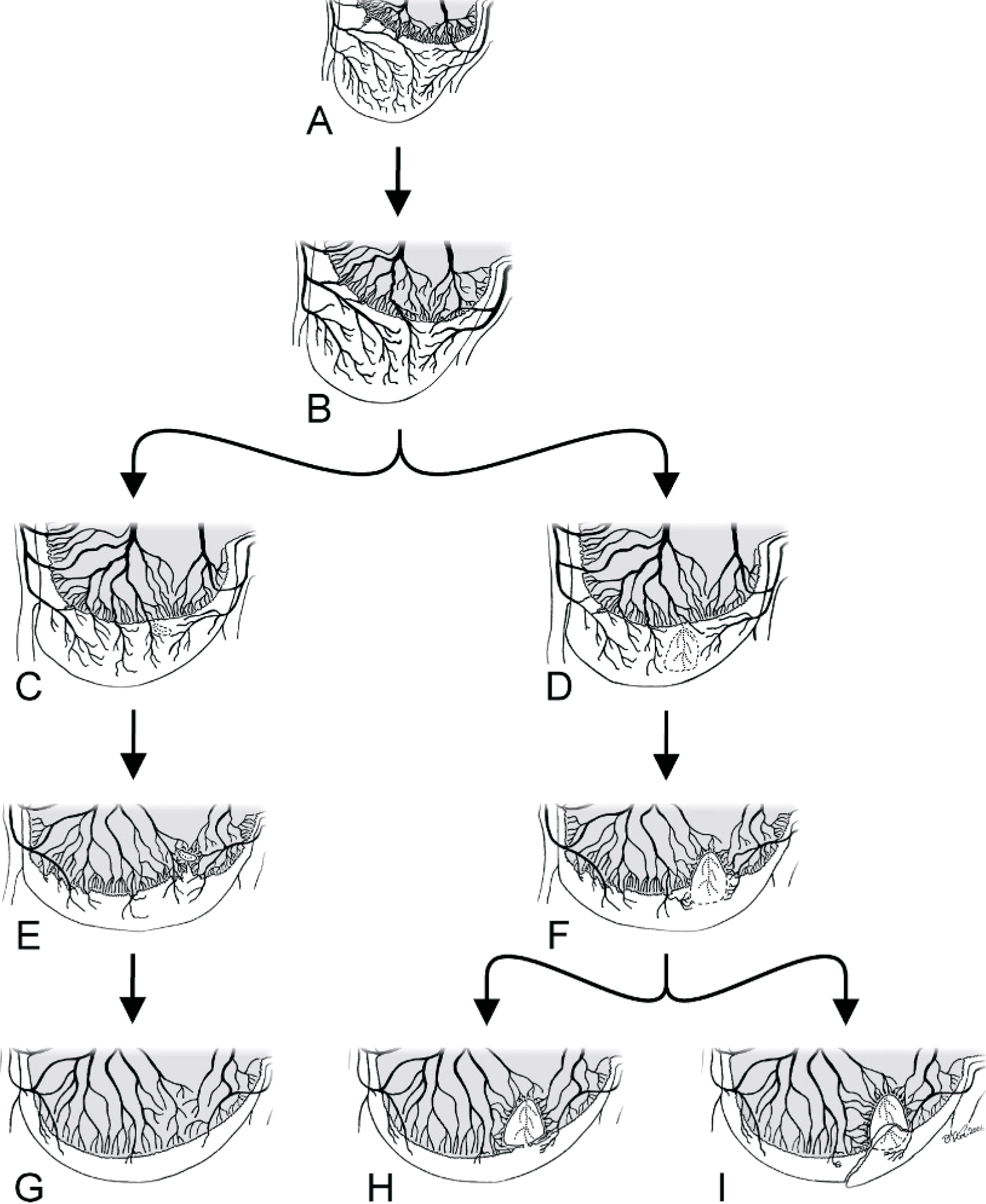
Рис. 7. Патогенезостеохондрозасуставов. Схематические изображения срезов эпифиза на разных стадиях развития. На ранней стадии (рис. 7a) эпифизарный хрящ снабжается кровью через большое количество сосудов, проходящих в хрящевых каналах, проникающих в хрящ из перихондрального сплетения. По мере роста животного, когда фронт окостенения достигает места прохождения хрящевого канала, ближайшего к метафизу (рис. 7b), сосуды в этом канале образуют анастомозы с сосудами фронта окостенения. В последующем области эпифизарного хряща получают кровь из сосудов хрящевых каналов, берущих начало от метафизарных сосудов фронта окостенения. Локальное нарушение кровотока в этих сосудах может вызвать ишемический некроз снабжаемого ими хряща (латентный остеохондроз; рис. 7с и 7d). Небольшой дефект (рис. 7c) может исчезнуть, когда до него дойдет фронт окостенения (рис. 7е и 7g), в то время как более крупный дефект (рис. 7f) будет мешать прорастанию сосудов и окостенению; он сохранится в виде конуса некротического хряща, пока фронт окостенения будет «обтекать» его (явный остеохондроз). Такое повреждение может стать полностью окруженным костной тканью (рис. 6h) и постепенно заместится фиброзной тканью, которая в последующем может претерпеть мембранозное окостенение. Однако в некоторых случаях вышележащий суставной хрящ разрывается (рис. 7i), вызывая повреждение, характерное для рассекающего остеохондроза. Источник рисунка: EkmanandCarlson, Ytrehusс соавторами, с измеениями.19,135,137
Тем не менее одно из наших недавних исследований134 не смогло доказать связи между нарушением хондрификации хрящевых каналов и появлением характерных для остеохондроза повреждений, как и связи между быстрым ростом и хондрификацией хрящевых каналов или остеохондрозными проявлениями. Таким образом, исследование не подтверждает предположения, что остеохондроз вызван общим нарушением кровоснабжения хрящевого канала. Тем не менее, экспериментальные исследования показывают, что нарушение кровоснабжения через хрящевой канал быстро приводит к некрозу сосудов хрящевого канала с последующим некрозом окружающего хряща покоящейся зоны ростовой пластинки, то есть изменения, типичные для спонтанного остеохондроза.12,137 Эти данные дают основания полагать, что спонтанно развившийся остеохондроз – последствие локального события, вызывающего недостаточность ограниченного числа хрящевых каналов. Подтверждая данную теорию, наши недавние исследования с перфузией и просветлением срезов суставного-эпифизарного хряща растущих свиней показали, что некроз хрящевого канала обычно очаговый и возникает чуть дистальнее точки, в которой сосуды канала пересекают костно-хрящевое соединение.136 Некроз поражает весь канал дистальнее этой точки, то есть первичное повреждение происходит на границе между хрящом и костью. Эти результаты доказывают, что в области суставного/эпифизарного хряща дистальной части бедренной кости свиней в определенный возрастной период изменяется кровоснабжение: с сосудов хрящевого канала, берущих начало в надхрящнице, на сосуды, берущие начало в костном мозге (рис. 7). По мере того, как животное растет, а хрящ становится тоньше, некоторые сосуды хрящевых каналов дуговидной формы с низшей точкой в средней части хряща окружаются продвигающимся фронтом окостенения и формируют новые анастомозы с сосудами костного мозга. Вероятно, что эти новые анастомозы, пересекающие зону интенсивного ремоделирования, окруженные хрящевыми шипиками с предположительно слабыми биомеханическими свойствами и первичной губчатой костью, подвергаются значительным механическим нагрузкам, склонны к деформации и повреждениям.
Таким образом, мы полагаем, что первичным событием при остеохондрозе является прекращение кровоснабжения хрящевого канала в результате повреждения временных и новообразованных сосудов. В медиальном мыщелке бедренной кости свиней эти сосуды существуют только в возрасте примерно от 8 до 13 недель.136 Эта теория, основанная на данных исследований свиней, объясняет довольно специфичную локализацию повреждений при остеохондрозе и наличие определенного возрастного периода восприимчивости к заболеванию, а также объясняет, почему повреждения часто двусторонне-симметричные.
Последствия остеохондроза могут перевесить само заболевание
После ишемического некроза хряща ростовых пластинок можно прогнозировать два типа реакции, оба из которых показаны экспериментально.137 Во-первых, хрящевой матрикс некротической зоны дегенерирует, так как его больше не поддерживают хондроциты. Во-вторых, в окружающих тканях (вышележащем суставном хряще, синовиальной оболочке, соседнем хряще зон роста и тканях продвигающегося фронта окостенения) наблюдается реакция, предположительно вызванная высвобождением компонентов структурного матрикса, а также связанных с матриксом ферментов и сигнальных молекул.
Способность вышележащего суставного хряща, не содержащего сосудов, отвечать на повреждение ограничена; однако хрящ зон роста вдоль границ некротической зоны пролиферирует и усиленно вырабатывает матрикс, хотя эффективное восстановление без удаления некротической ткани невозможно. Кроме того, хондроциты растущего хряща способны к усиленной выработке ангиогенного фактора ФРЭС136,137 и, предположительно, широкого спектра маркеров воспаления.24,28,83 Дополнительно - сосуды хрящевых каналов в окружающем жизнеспособном хряще пролиферируют в направлении некротической области;136,137 этот процесс, вероятно, сопровождается протеолизом хрящевого матрикса. В подхрящевой кости, соседней с некротическим хрящом, развивается воспалительная реакция, при которой в костном мозге появляется смесь активных остеобластов, активных остеокластов и хондрокластов, воспалительных и веретеновидных клеток.136 В случаях явного остеохондроза, пока расщелина в вышележащем суставном хряще еще не образовалась, эта реакция часто связана с видимым снижением размера некротической ткани и формированием гранулематозной ткани, которая в последующем превращается в кость за счет мембранозного окостенения. Альтернативно - в случаях, когда зона некротического хряща сохраняется, может развиться подхрящевая костная киста.
Был проведен ряд исследований, посвященных биохимическим и молекулярным свойствам ткани в очагах остеохондроза.65,67,68,102,103,117 Пораженную ткань собирают на основании ее макроскопической картины и сравнивают с тканью из тех же участков, выглядящей нормально. Эти исследования проводятся с целью лучшего понимания патогенеза заболевания; однако такие макроскопические повреждения по определению являются хроническими и, таким образом, взятая ткань отражает поздние события патологического процесса. Результаты следует интерпретировать с осторожностью, так как вероятно, что они представляют собой доказательства активации разнообразных воспалительных, катаболических и анаболических факторов, отражающие текущий процесс разрушения некротического хряща и формирования восстановительной ткани.3
Большинство предыдущих исследований были сосредоточены на хронических стадиях заболевания; таким образом, считается, что все факторы, влияющие на организм больного в период между формированием начальных изменений и хроническими стадиями болезни, часто действующие на протяжении многих месяцев и даже лет, участвуют в инициации и прогрессировании остеохондроза, при этом многие из них, вероятнее, отражают восстановительные процессы. Кроме того, молекулярные исследования тканей, отражающих эти хронические изменения, вряд ли могут дать информацию, относящуюся к начальной стадии развития заболевания.
Выводы
На основании всех имеющихся доказательств мы полагаем, что первичные повреждения вследствие суставного остеохондроза следует классифицировать как очаговый ишемический некроз хряща зон роста, инициированный некрозом кровеносных сосудов в хрящевых каналах. Так как некротический хрящ не подвергается минерализации и в него не прорастают сосуды, при приближении фронта окостенения к пораженному участку развивается локальное нарушение энхондрального окостенения.
Учитывая длительную историю и широкое распространение термина «остеохондроз», мы рекомендуем продолжать использовать этот термин, однако предлагаем добавлять определяющие слова «латентный», «явный» и «рассекающий». В дистальной части бедренной кости свиней некроз сосудов хрящевого канала, по-видимому, инициируется нарушением кровоснабжения через временные и, предположительно, уязвимые сосуды, идущие из костного мозга в хрящ в течение короткого возрастного периода в фазу роста. Можно ожидать, что патогенез при других локализация и у других видов сходен. Патогенез остеохондроза ростовых пластинок по-прежнему плохо изучен; однако вероятна роль нарушения кровоснабжения с эпифизарной или метафизарной стороны пластинки.
Большинство доказательств поддерживает наследственные и анатомические факторы как вносящие наиболее значимый вклад в патогенез остеохондроза (рис. 8). Очаговая природа повреждений говорит о том, что будущие исследования следует посвятить специфическим особенностям, таким как конформация сустава и движения в суставе. Вероятно, что микротравма сосудов в зоне костно-хрящевого соединения может стать инициирующим событием при формировании поражений. Анатомическая предрасположенность, например неблагоприятная конформация сустава, может повысить механические нагрузки на эту область в ограниченный период существования этих сосудов. Кроме того, можно предположить, что факторы окружающей среды способны усилить механические нагрузки на структуры, подвергающиеся риску (рис. 8). Значительная травма, по-видимому, не играет большой роли в большинстве случаев остеохондроза. Однако значительная травма или локальная инфекция растущего эпифиза может изменить кровоснабжение пораженного участка. Таким образом, в редких случаях такие события могут вызвать локальный ишемический некроз хряща в зоне роста (т. е. вторичный остеохондроз) в любом месте, в том числе нетипичном для остеохондроза (рис. 8).92 Хотя полагают, что травма не является значимым этиологическим фактором остеохондроза, довольно вероятно, что она играет большую роль в прогрессировании повреждений, характерных для явного остеохондроза, до рассекающего остеохондроза (рис. 8).
Генерализованные факторы, такие как нарушения гемодинамики или дисбаланс компонентов рациона, могут участвовать в патогенезе остеохондроза только при условии, что они изменяют функцию хрящевого канала, либо путем непосредственного воздействия на сосуды, либо в результате изменения биомеханических свойств окружающих структур (рис. 8). В последних случаях может быть оправданным считать вторичными остеохондрозные повреждения, развившиеся в результате на фоне генерализованного состояния.92
Доказательств в пользу влияния массы тела животного на распространенность ранних изменений вследствие остеохондроза мало. Однако представляется правдоподобным, что большая масса тела ускоряет прогрессирование от остеохондроза к остеоартриту. К доказательствам в пользу этого заявления относятся наблюдения, говорящие о значимости ожирения для прогрессирования остеоартрита у людей23 и корреляции распространенности/тяжести остеоартрита с массой тела у собак (рис. 8).58,111
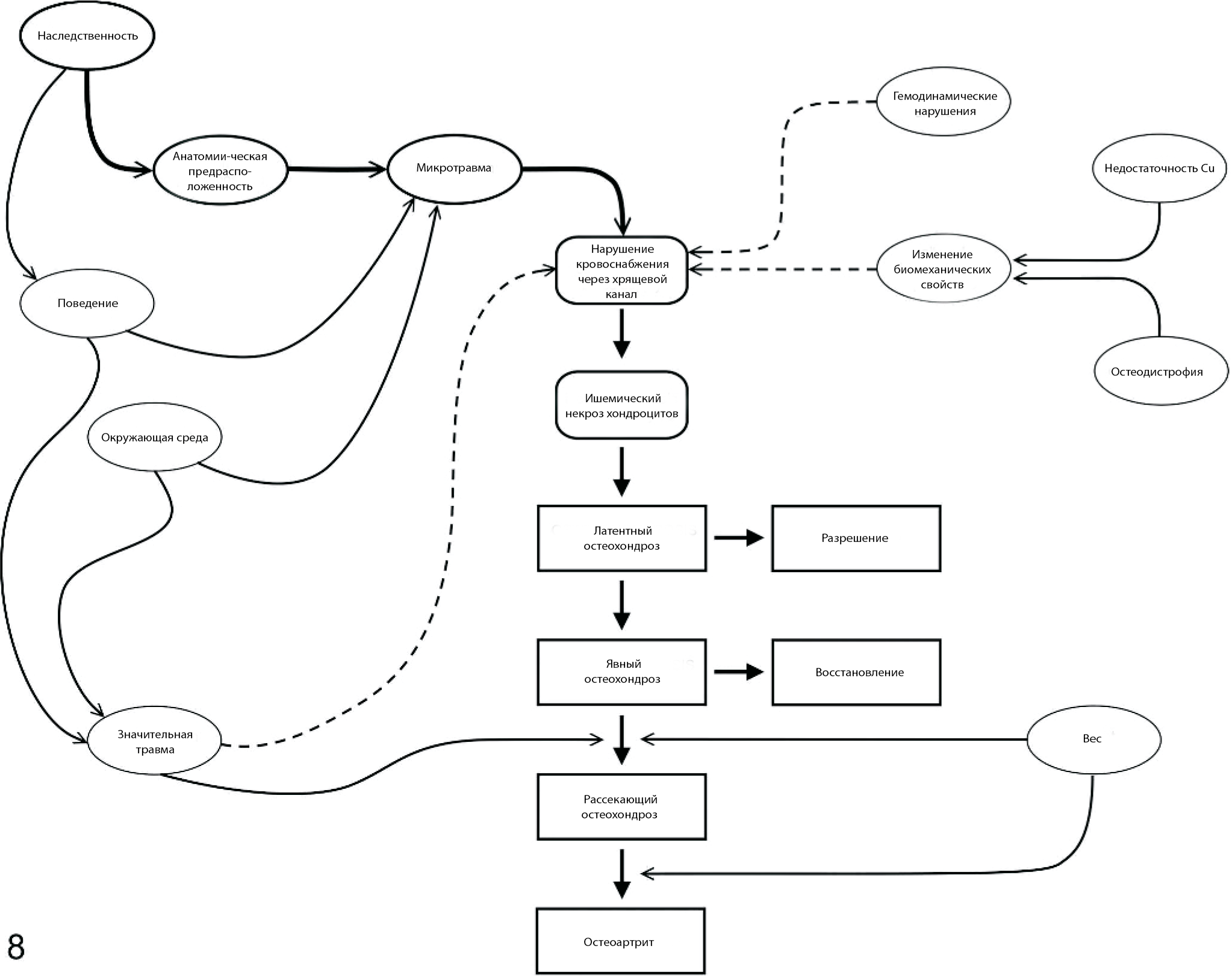
Рис. 8. Диаграмма причинно-следственных связей, показывающая вероятные этиологические факторы остеохондроза и их возможное влияние на развитие болезни. Факторы, играющие наиболее важную роль при первичном остеохондрозе, выделены жирными рамками и сплошными линиями со стрелками, а факторы, способные играть роль во вторичном остеохондрозе, изображены точечными линиями со стрелками.
Теория патогенеза, при котором некроз хрящевых каналов является решающей стадией, позволяет объяснить многие из аспектов остеохондроза, в то время как другие теории не позволяют сделать этого.19 Например, так как перед наступлением взрослости эпифизарный хрящ становится аваскулярным, эта теория объясняет, почему остеохондроз развивается только в период роста скелета. Кроме того, она объясняет предрасположенность определенных участков к остеохондрозу, а также тенденцию к симметричности, так как кровоснабжение анатомической области обычно довольно постоянно у разных видов и симметрично с обеих сторон. Из этой теории вытекает важное клиническое заключение, что повреждения при остеохондрозе формируются в очень ограниченный период времени, в частности в период, когда эпифизарный хрящ снабжается кровью через уязвимые кровеносные сосуды. Таким образом, профилактические меры необходимо принимать в этот период, который несколько варьируется в зависимости от вида животных и анатомической области.
Выбор научного подхода к изучению остеохондроза основывается на понимании первичных патологических процессов, различных стадий заболевания (латентный, явный и рассекающий остеохондроз), многофакторной этиологии и относительно длительного времени от формирования первичных повреждений до клинических проявлений заболевания.
Литература
1 Ballock RT, O’Keefe RJ: Physiology and pathophysiology of the growth plate. Birth Defects Res C Embryo Today 69:123–143, 2003.
2 Barrie HJ: Osteochondritis dissecans 1887–1987. A centennial look at Konig’s memorable phrase. J Bone Joint Surg Br 69:693–695, 1987.
3 Bertone AL, Bramlage LR, McIlwraith CW, Malemud CJ: Comparison of proteoglycan and collagen in articular cartilage of horses with naturally developing osteochondrosis and healing osteochondral fragments of experimentally induced fractures. Am J Vet Res 66:1881–1890, 2005.
4 Blitz NM, Yu JH: Freiberg’s infraction in identical twins: a case report. J Foot Ankle Surg 44:218–221, 2005.
5 Bohndorf K: Osteochondritis (osteochondrosis) dissecans: a review and new MRI classification. Eur Radiol 8:103–112, 1998
6 Bravo C, Kawamura H, Yamaguchi T, Hotokebuchi T, Sugioka Y: Experimental osteochondritis dissecans - the role of cartilage canals in chondral fractures of young rabbits. Fukuoka Acta Med 87:133–141, 1996.
7 Brower AC: The osteochondroses. Orthop Clin North Am 14:99–117, 1983.
8 Byers PD, Brown RA: Cell columns in articular cartilage physes questioned: a review. Osteoarthritis Cartilage 14:3-12, 2006.
9 Carlson CS, Cullins LD, Meuten DJ: Osteochondrosis of the articular-epiphyseal cartilage complex in young horses: evidence for a defect in cartilage canal blood supply. Vet Pathol 32:641–647, 1995.
10 Carlson CS, Hilley HD, Meuten DJ: Degeneration of cartilage canal vessels associated with lesions of osteochondrosis in swine. Vet Pathol 26:47–54, 1989.
11 Carlson CS, Hilley HD, Meuten DJ, Hagan JM, Moser RL: Effect of reduced growth rate on the prevalence and severity of osteochondrosis in gilts. Am J Vet Res 49:396–402, 1988.
12 Carlson CS, Meuten DJ, Richardson DC: Ischemic necrosis of cartilage in spontaneous and experimental lesions of osteochondrosis. J Orthop Res 9:317–329, 1991.
13 Carter DR, Beaupre GS, Wong M, Smith RL, Andriacchi TP, Schurman DJ: The mechanobiology of articular cartilage development and degeneration. Clin Orthop Relat Res 427(Suppl): S69–S77, 2004.
14 Carter DR, Wong M: Modelling cartilage mechanobiology. Philos Trans R Soc Lond B Biol Sci 358:1461–1471, 2003.
15 Colnot C: Cellular and molecular interactions regulating skeletogenesis. J Cell Biochem 95:688–697, 2005.
16. Da¨mmrich K: Relationship between nutrition and bone growth in large and giant dogs. J Nutr 121:S114–S121, 1991.
17 De Lahunta A, Hedhammar A, Wu FM, Krook L: Overnutrition and skeletal disease. An experimental study in growing Great Dane dogs. VII. Cervical vertebrae and spinal cord. Cornell Vet 64(Suppl 5): 58–71, 1974.
18 Dewey C: Diseases of the nervous and locomotor systems. In: Diseases of Swine, ed. Straw B, D’Allaire S, Mengeling W, and Taylor D, 8th ed., pp. 861–883. Blackwell Science, Oxford, UK, 1999.
19 Ekman S, Carlson CS: The pathophysiology of osteochondrosis. Vet Clin North Am Small Anim Pract 28:17–32, 1998.
20 Ekman S, Heinega˚rd D: Immunohistochemical localization of matrix proteins in the femoral joint cartilage of growing commercial pigs. Vet Pathol 29:514–520, 1992.
21 Ekman S, Heinega˚rd D, Johnell O, Rodriguez-Martinez H: Immunohistochemical localization of proteoglycans and non-collagenous matrix proteins in normal and osteochondrotic porcine articular-epiphyseal cartilage complex. Matrix 10:402–411, 1990.
22 Ekman S, Rodriguez-Martinez H, Ploen L: Morphology of normal and osteochondrotic porcine articular-epiphyseal cartilage. A study in the domestic pig and minipig of wild hog ancestry. Acta Anat 139:239–253, 1990.
23 Felson DT: An update on the pathogenesis and epidemiology of osteoarthritis. Radiol Clin North Am 42:1–9, v, 2004.
24 Fernandes JC, Martel-Pelletier J, Pelletier JP: The role of cytokines in osteoarthritis pathophysiology. Biorheology 39:237–246, 2002.
25 Ganey TM, Love SM, Ogden JA: Development of vascularization in the chondroepiphysis of the rabbit. J Orthop Res 10:496–510, 1992.
26 Gee E, Davies M, Firth E, Jeffcott L, Fennessy P, Mogg T: Osteochondrosis and copper: histology of articular cartilage from foals out of copper supplemented and non-supplemented dams. Vet J 173:111–119, 2007.
27 Gerber HP, Vu TH, Ryan AM, Kowalski J, Werb Z, Ferrara N: VEGF couples hypertrophic cartilage remodeling, ossification and angiogenesis during endochondral bone formation. Nat Med 5:623–628,
1999.
28 Goldring MB: The role of the chondrocyte in osteoarthritis. Arthritis Rheum 43:1916–1926, 2000
29 Goldring MB, Tsuchimochi K, Ijiri K: The control of chondrogenesis. J Cell Biochem 97:33–44, 2006.
30 Graat HC, van Rhijn LW, Schrander-Stumpel CT, van Ooij A: Classical Scheuermann disease in male monozygotic twins: further support for the genetic etiology hypothesis. Spine 27:E485–E487, 2002.
31 Grøndahl AM, Dolvik NI: Heritability estimations of osteochondrosis in the tibiotarsal joint and of bony fragments in the palmar/plantar portion of the metacarpo- and metatarsophalangeal joints of horses. J Am Vet Med Assoc 203:101–104, 1993.
32 Grøndalen T: Osteochondrosis and arthrosis in pigs. II. Incidence in breeding animals. Acta Vet Scand 15:26–42, 1974.
33 Grøndalen T: Osteochondrosis and arthrosis in pigs. III. A comparison of the incidence in young animals of the Norwegian Landrace and Yorkshire breeds. Acta Vet Scand 15:43–52, 1974.
34 Grøndalen T: Osteochondrosis and arthrosis in pigs. VI. Relationship to feed level and calcium phosphorus and protein levels in the ration. Acta Vet Scand 15:147–169, 1974.
35 Grøndalen T: Leg weakness in pigs. II. Litter differences in leg weakness, skeletal lesions, joint shape and exterior conformation. Acta Vet Scand 15:574–586, 1974.
36 Grøndalen T: Osteochondrosis and arthrosis in pigs. VII. Relationship to joint shape and exterior conformation. Acta Vet Scand Suppl 46:1–32, 1974.
37 Grøndalen T: Osteochondrosis, arthrosis and leg weakness in pigs. Nord Vet Med 26:534–537, 1974.
38 Grøndalen T: Osteochondrosis and arthrosis in Norwegian slaughter-pigs in 1980 compared to 1970. Nord Vet Med 33:417–422, 1981.
39 Grøndalen T, Grøndalen J: Osteochondrosis and arthrosis in pigs. IV. Effect of overloading on the distal epiphyseal plate of the ulna. Acta Vet Scand 15:53–60, 1974.
40 Grøndalen T, Vangen O: Osteochondrosis and arthrosis in pigs. V. A comparison of the incidence in three different lines of the Norwegian Landrace breed. Acta Vet Scand 15:61–79, 1974.
41 Gustavel M, Beals RK: Scheuermann’s disease of the lumbar spine in identical twins. AJR Am J Roentgenol 179:1078–1079, 2002.
42 Haines RW: The pseudoepiphysis of the first metacarpal of man. J Anat 117:145–158, 1974.
43 Hall AP, Westwood FR, Wadsworth PF: Review of the effects of anti-angiogenic compounds on the epiphyseal growth plate. Toxicol Pathol 34:131–147, 2006.
44 Handeland K, Bernhoft A: Osteochondrosis associated with copper deficiency in a red deer herd in Norway. Vet Rec 155:676–678, 2004.
45 Harari J: Osteochondrosis. Vet Clin North Am Small Anim Pract 28:87–94, 1998.
46 Hayashi K: Three-dimensional organization of the cartilage canal–a scanning electron-microscopic study by vascular cast of the rabbit’s femoral head. Nippon Seikeigeka Gakkai Zasshi 66:548–559, 1992
47 Hedhammar A˚ , Wu FM, Krook L, Schryver HF, De Lahunta A, Whalen JP, Kallfelz FA, Nunez EA, Hintz HF, Sheffy BE, Ryan GD: Overnutrition and skeletal disease. An experimental study in growing Great Dane dogs. Cornell Vet 64(Suppl 5): 5–160, 1974.
48 Hill MA, Kincaid SA, Visco DM: Use of histochemical techniques in the characterisation of osteochondroses affecting pigs. Vet Rec 127:29–37, 1990.
49 Hill MA, Ruth GR, Hilley HD, Hansgen DC: Dyschondroplasias, including osteochondrosis, in boars between 25 and 169 days of age: histologic changes. Am J Vet Res 45:903–916, 1984.
50 Howald H: Zur Kenntnis der Osteochondrosis dissecans (Osteochondritis dissecans). Archiv fur orthopaedische und Unfall-Chirurgie 41:730–788, 1942.
51 Hurtig M, Green SL, Dobson H, Mikuni-Takagaki Y, Choi J: Correlative study of defective cartilage and bone growth in foals fed a low-copper diet. Equine Vet J 16 (Suppl): 66–73, 1993.
52 Jeffcott LB, Henson FM: Studies on growth cartilage in the horse and their application to aetiopathogenesis of dyschondroplasia (osteochondrosis). Vet J 156:177–192, 1998.
53 Jensen R, Park RD, Lauerman LH, Braddy PM, Horton DP, Flack DE, Cox MF, Einertson N, Miller GK, Rehfeld CE: Osteochondrosis in feedlot cattle. Vet Pathol 18:529–535, 1981.
54 Jørgensen B, Andersen S: Genetic parameters for osteochondrosis in Danish Landrace and Yorkshire boars and correlations with leg weakness and production traits. Anim Sci 71:427–434, 2000.
55 Jørgensen B, Arnbjerg J, Aaslyng M: Pathological and radiological investigations on osteochondrosis in pigs, associated with leg weakness. Zentralbl Veterina¨rmed A 42:489–504, 1995.
56 Juppner H: Role of parathyroid hormone-related peptide and Indian hedgehog in skeletal development. Pediatr Nephrol 14:606–611, 2000.
57 Kato M, Onodera T: Early changes of osteochondrosis in medial femoral condyles from rats. Vet Pathol 24:80–86, 1987.
58 Kealy RD, Lawler DF, Ballam JM, Lust G, Smith GK, Biery DN, Olsson SE: Five-year longitudinal study on limited food consumption and development of osteoarthritis in coxofemoral joints of dogs. J Am Vet Med Assoc 210:222–225, 1997.
59 Kincaid SA, Allhands RV, Pijanowski GJ: Chondrolysis associated with cartilage canals of the epiphyseal cartilage of the distal humerus of growing pigs. Am J Vet Res 46:726–732, 1985.
60 Knight DA, Weisbrode SE, Schmall LM, Reed SM, Gabel AA, Bramlage LR, Tyznik WI: The effects of copper supplementation on the prevalence of cartilage lesions in foals. Equine Vet J 22:426–432, 1990.
61 Ko¨ nig F: Ueber freie Ko¨ rper in den Gelenken [On Loose Bodies in the Joints]. Deutsche Zeitschrift fu¨r Chirurgie 27:90–109, 1888.
62 Kowalczyk DF, Gunson DE, Shoop CR, Ramberg CFJr: The effects of natural exposure to high levels of zinc and cadmium in the immature pony as a function of age. Environ Res 40:285–300, 1986.
63 Kronenberg HM: Developmental regulation of the growth plate. Nature 423:332–336, 2003.
64 Kugler JH, Tomlinson A, Wagstaff A, Ward SM: The role of cartilage canals in the formation of secondary centres of ossification. J Anat 129:493–506, 1979.
65 Kuroki K, Cook JL, Stoker AM, Turnquist SE, Kreeger JM, Tomlinson JL: Characterizing osteochondrosis in the dog: potential roles for matrix metalloproteinases and mechanical load in pathogenesis and disease progression. Osteoarthritis Cartilage 13:225–234, 2005.
66 LaFond E, Breur GJ, Austin CC: Breed susceptibility for developmental orthopedic diseases in dogs. J Am Anim Hosp Assoc 38:467–477, 2002.
67 Laverty S, Ionescu M, Marcoux M, Boure L, Doize B, Poole AR: Alterations in cartilage type-II procollagen and aggrecan contents in synovial fluid in equine osteochondrosis. J Orthop Res 18:399–405, 2000.
68 Laverty S, Okouneff S, Ionescu M, Reiner A, Pidoux I, Webber C, Rossier Y, Billinghurst RC, Poole AR: Excessive degradation of type II collagen in articular cartilage in equine osteochondrosis. J Orthop Res 20:1282–1289, 2002.
69 Lee ER, Lamplugh L, Shepard NL, Mort JS: The septoclast, a cathepsin B-rich cell involved in the resorption of growth plate cartilage. J Histochem Cytochem 43:525–536, 1995.
70 Lefebvre V, Smits P: Transcriptional control of chondrocyte fate and differentiation. Birth Defects Res C Embryo Today 75:200–212, 2005.
71 Leighton RL: Historical perspectives of osteochondrosis. Vet Clin North Am Small Anim Pract 28:1–16, 1998.
72 Levene C: The pattern of cartilage canals. J Anat 98:515–538, 1964.
73 Ljunggren G, Reiland S: Osteochondrosis in adolescent animals: an endocrine disorder? Calcif Tissue Res 6 (Suppl) 4: 150–151, 1969.
74 Lundeheim N: Genetic analysis of osteochondrosis and leg weakness in the Swedish pig progeny testing scheme. Acta agriculturæ Scandinavica 37:159– 173, 1987.
75 Lutfi AM: Mode of growth, fate and functions of cartilage canals. J Anat 106:135–145, 1970.
76 McIlwraith CW: Diseases of joints, tendons, ligaments, and related structures. In: Adams’Lameness in Horses, ed. Stashak TS, 5th ed., pp. 459–644. Lippincott Williams & Wilkins, Baltimore, MD, 2002.
77 Morgan J, Wind A, Davidson A: Introduction. In: Hereditary Bone and Joint Diseases in the Dog: Osteochondroses, Hip Dysplasia, Elbow Dysplasia, pp. 1–19. Schlu¨ tersche GmbH & Co. KG Verlag und Druckerei, Hannover, Germany, 1999.
78 Nagura S: The so-called osteochondritis dissecans of Ko¨ nig. Clin Orthop 18:100–121, 1960.
79 Nakano T, Aherne FX: Involvement of trauma in the pathogenesis of osteochondritis dissecans in swine. Can J Vet Res 52:154–155, 1988.
80 Nakano T, Aherne FX, Brennan JJ, Thompson JR: Effect of growth rate on the incidence of osteochondrosis in growing swine. Can J Anim Sci 64:139–146, 1984.
81 Nakano T, Aherne FX, Thompson JR: Effects of feed restriction, sex and diethylstilbestrol on the occurence of joint lesions with some histological and biochemical studies of the articular cartilage of growing-finishing swine. Can J Anim Sci 59: 491–502, 1979.
82 Nakano T, Brennan JJ, Aherne FX: Leg weakness and osteochondrosis in swine: a review. Can J Anim
Sci 67:883–901, 1987.
83 Nesic D, Whiteside R, Brittberg M, Wendt D, Martin I, Mainil-Varlet P: Cartilage tissue engineering for degenerative joint disease. Adv Drug Deliv Rev 58:300–322, 2006.
84 Nordahl J, Andersson G, Reinholt FP: Chondroclasts and osteoclasts in bones of young rats: comparison of ultrastructural and functional features. Calcif Tissue Int 63:401–408, 1998.
85 Olsson SE: General and local aetiologic factors in canine osteochondrosis. Vet Q 9:268–278, 1987.
86 Olsson SE, Reiland S: The nature of osteochondrosis in animals. Summary and conclusions with comparative aspects on osteochondritis dissecans in man. Acta Radiol Suppl 358:299–306, 1978.
87 Padgett GA, Mostosky UV, Probst CW, Thomas MW, Krecke CF: The inheritance of osteochondritis dissecans and fragmented coronoid process of the elbow joint in labrador retrievers. J Am Anim Hosp Assoc 31:327–330, 1995.
88 Palmer N: Bones and joints. In: Pathology of Domestic Animals, ed. Jubb KVF, Kennedy PC, and Palmer N, 4th ed., vol. 1, pp. 1–181. Academic Press, San Diego, CA, USA, 1993.
89 Pearce SG, Firth EC, Grace ND, Fennessy PF: Effect of copper supplementation on the evidence of developmental orthopaedic disease in pasturefed New Zealand Thoroughbreds. Equine Vet J 30:211–218, 1998.
90 Peterson RK, Savoie FH 3rd, Field LD: Osteochondritis dissecans of the elbow. Instr Course Lect 48:393–398, 1999.
91 Philipsson J: Pathogenesis of osteochondrosis -genetic implications. In: Joint Disease in the Horse, ed. McIlwraith CW and Trotter G, pp. 359–362. WB Saunders, Philadelphia, PA, 1996.
92 Pool RR: Difficulties in definition of equine osteochondrosis; differentiation of developmental and acquired lesions. Equine Vet J, Suppl 16:5–12, 1993.
93 Provot S, Schipani E: Molecular mechanisms of endochondral bone development. Biochem Biophys Res Commun 328:658–665, 2005.
94 Ralphs SC: Bilateral stifle osteochondritis dissecans in a cat. J Am Anim Hosp Assoc 41:78–80, 2005.
95 Rath NC, Richards MP, Huff WE, Huff GR, Balog JM: Changes in the tibial growth plates of chickens with thiram-induced dyschondroplasia. J Comp Pathol 133:41–52, 2005.
96 Reiland S: Osteochondrosis in the Pig [thesis]. pp. 1–118. The Royal Veterinary College, Stockholm, Sweden, 1975.
97 Richardson DC, Zentek J: Nutrition and osteochondrosis. Vet Clin North Am Small Anim Pract 28:115–135, 1998.
98 Riddel C: Studies on the pathogenesis of tibial dyschondroplasia in chickens. I. Production of similar defect by surgical interference. Avian Dis 19:483–389, 1975.
99 Robertson W, Kelly BT, Green DW: Osteochondritis dissecans of the knee in children. Curr Opin Pediatr 15:38–44, 2003.
100 Schenck RC Jr, Goodnight JM: Osteochondritis dissecans. J Bone Joint Surg Am 78:439–456, 1996.
101 Schoenmakers I, Hazewinkel HAW, Voorhout G, Carlson CS, Richardson D: Effect of diets with different calcium and phosphorus contents on the skeletal development and blood chemistry of growing great danes. Vet Rec 147:652–660, 2000.
102 Semevolos SA, Brower-Toland BD, Bent SJ, Nixon AJ: Parathyroid hormone-related peptide and indian hedgehog expression patterns in naturally acquired equine osteochondrosis. J Orthop Res 20:1290–1297, 2002.
103 Semevolos SA, Strassheim ML, Haupt JL, Nixon AJ: Expression patterns of hedgehog signaling peptides in naturally acquired equine osteochondrosis. J Orthop Res 23:1152–1159, 2005.
104 Shapiro F: Epiphyseal and physeal cartilage vascularization: a light microscopic and tritiated thymidine autoradiographic study of cartilage canals in newborn and young postnatal rabbit bone. Anat Rec 252:140–148, 1998.
105 Shingleton WD, Mackie EJ, Cawston TE, Jeffcott LB: Cartilage canals in equine articular/epiphyseal growth cartilage and a possible association with dyschondroplasia. Equine Vet J 29:360–364, 1997.
106 Shum L, Coleman CM, Hatakeyama Y, Tuan RS: Morphogenesis and dysmorphogenesis of the appendicular skeleton. Birth Defects Res C Embryo Today 69:102–122, 2003.
107 Siffert RS: Classification of the osteochondroses. Clin Orthop Relat Res 158:10–18, 1981.
108 Skelly CM, McAllister H, Donnelly WJ: Avulsion of the tibial tuberosity in a litter of greyhound puppies. J Small Anim Pract 38:445–449, 1997.
109 Smillie IS: Introduction. In: Osteochondritis Dissecans, pp. 3–10. E & S Livingstone Ltd., Edinburgh and London, UK, 1960.
110 Smillie IS: Etiology and pathology: summary. In: Osteochondritis Dissecans, pp. 114–115. E & S Livingstone Ltd., Edinburgh and London, UK,1960.
111 Smith GK, Mayhew PD, Kapatkin AS, McKelvie PJ, Shofer FS, Gregor TP: Evaluation of risk factors for degenerative joint disease associated with hip dysplasia in German Shepherd Dogs, Golden Retrievers, Labrador Retrievers, and Rottweilers. J Am Vet Med Assoc 219:1719–1724, 2001.
112 Stern S, Lundeheim N, Johansson K, Andersson K: Osteochondrosis and leg weakness in pigs selected
for lean tissue growth rate. Livestock Production Science 44:45–52, 1995.
113 Stockwell RA: The ultrastructure of cartilage canals and the surrounding cartilage in the sheep fetus. J Anat 109:397–410, 1971.
114 Thompson KG, Audige L, Arthur DG, Julian AF, Orr MB, McSporran KD, Wilson PR: Osteochondrosis associated with copper deficiency in young farmed red deer and wapiti x red deer hybrids. N Z Vet J 42:137–143, 1994.
115 Thorp BH, Duff SR: Effect of unilateral weightbearing on pelvic limb development in broiler fowls: vascular studies. Res Vet Sci 44:164–174, 1988.
116 Thorp BH, Farquharson C, Kwan APL, Loveridge N: Osteochondrosis/dyschondroplasia: a failure of chondrocyte differentiation. Equine Vet J , Suppl 16:13–18, 1993.
117 Tomlinson JL, Cook JL, Kuroki K, Kreeger JM, Anderson MA: Biochemical characterization of cartilage affected by osteochondritis dissecans in the humeral head of dogs. Am J Vet Res 62:876–881, 2001.
118 Trueta J, Trias A: The vascular contribution to osteogenesis. IV. The effect of pressure upon the epiphyseal cartilage of the rabbit. J Bone Joint Surg Br 43B:800–813, 1961.
119 Tryfonidou MA, Holl MS, Stevenhagen JJ, Buurman CJ, Deluca HF, Oosterlaken-Dijksterhuis MA, van den Brom WE, van Leeuwen JPTM, Hazewinkel HAW: Dietary 135-fold cholecalciferol supplementation severely disturbs the endochondral ossification in growing dogs. Domest Anim Endocrinol 24:265–285, 2003.
120 Tsirikos AI, Riddle EC, Kruse R: Bilateral Kohler’s disease in identical twins. Clin Orthop Relat Res 409:195–198, 2003.
121 Uhlhorn H, Dalin G, Lundeheim N, Ekman S: Osteochondrosis in wild boar-Swedish Yorkshire crossbred pigs (F2 generation). Acta Vet Scand 36:41–53, 1995.
122 van der Wal PG, van der Valk PC, Goedegebuure SA, van Essen G: Osteochondrosis in six breeds of slaughter pigs. II. Data concerning carcass characteristics in relation to osteochondrosis. Vet Q 2:42–47, 1980.
123 Vigorita VJ: Orthopaedic Pathology. Lippincott Williams and Wilkins, Philadelphia, PA, 1999.
124 Visco DM, Hill MA, Van Sickle DC, Kincaid SA: The development of centres of ossification of bones forming elbow joints in young swine. J Anat 171:25–39, 1990.
125 Visco DM, Van Sickle DC, Hill MA, Kincaid SA: The vascular supply of the chondro-epiphyses of the elbow joint in young swine. J Anat 163:215–229,1989.
126 Wilsman NJ, Van Sickle DC: The relationship of cartilage canals to the initial osteogenesis of secondary centers of ossification. Anat Rec 168: 381–391, 1970.
127 Wilsman NJ, Van Sickle DC: Cartilage canals, their morphology and distribution. Anat Rec 173:79–93, 1972.
128 Woodard JC, Becker HN, Poulos PW Jr: Effect of diet on longitudinal bone growth and osteochondrosis in swine. Vet Pathol 24:109–117, 1987.
129 Woodard JC, Becker HN, Poulos PW Jr: Articular cartilage blood vessels in swine osteochondrosis. Vet Pathol 24:118–123, 1987.
130 Woodbury MR, Feist MS, Clark EG, Haigh JC: Osteochondrosis and epiphyseal bone abnormalities associated with copper deficiency in bison calves. Can Vet J 40:878–880, 1999.
131 Wu FM, Hedhammar A, Krook L: Overnutrition and skeletal disease. An experimental study in growing Great Dane dogs. IX. The long bones. Cornell Vet 64 (Suppl 5): 83–114, 1974.
132 Yamaguchi T, Hayashi K, Tayama N, Sugioka Y: The role of cartilage canals: experimental study using rabbits’ femoral heads. Nippon Seikeigeka Gakkai Zasshi 64:1105–1110, 1990.
133 Yazdi MH, Lundeheim N, Rydhmer L, Ringmar- Cederberg L, Johansson K: Survival of Swedish Landrace and Yorkshire sowns in relation to osteochondrosis; a genetic study. Anim Sci 71:1–9, 2000.
134 Ytrehus B, Carlson CS, Lundeheim N, Mathisen L, Reinholt FP, Teige J, Ekman S: Vascularisation and osteochondrosis of the epiphyseal growth cartilage of the distal femur in pigs–development with age, growth rate, weight and joint shape. Bone 34:454–465, 2004.
135 Ytrehus B, Grindflek E, Teige J, Stubsjoen E, Grondalen T, Carlson CS, Ekman S: The effect of parentage on the prevalence, severity and location of lesions of osteochondrosis in swine. J Vet Med A Physiol Pathol Clin Med 51:188–195, 2004.
136 Ytrehus B, Ekman S, Carlson CS, Teige J, Reinholt FP: Focal changes in blood supply during normal epiphyseal growth are central in the pathogenesis of osteochondrosis in pigs. Bone 35:1294–1306, 2004.
137 Ytrehus B, Haga H, Mellum C, Mathisen L, Carlson CS, Ekman S, Teige J, Reinholt FP: Experimental ischemia of porcine growth cartilage produces lesions of osteochondrosis. J Orthop Res 22:1201–1209, 2004.





