U. Krotscheck and T. Todhunter
Кафедра клинических наук, ветеринарный колледж, Итака, Нью-Йорк, США.
Дисплазия тазобедренного сустава (ДТБС) – одно из самых распространенных ортопедических заболеваний у собак. Тяжесть клинических симптомов варьируется от отдельных эпизодов хромоты до тяжелой дисфункции. Это сложное, полигенное или многофакторное заболевание, приводящее к остеоартриту (ОА) тазобедренного сустава. Данное нарушение развития наследуется количественно, а клинические и морфологические проявления зависят от воздействия наследственных и внешних факторов [1-3].
У собак, пораженных дисплазией ТБС, тазобедренные суставы выглядят нормальными при рождении, однако уже в первые недели жизни развивается гиперподвижность сустава с потерей конгруэнтности [2,4-6]. Утверждается, что развивающаяся изначально гиперподвижность сустава в последующем ведет к подвывиху при опоре на конечности, вызывающему растяжение суставной капсулы. В результате такой травмы суставная капсула утолщается, формируются остеофиты и энтезиофиты [7]. Этиология, лежащая в основе гиперподвижности сустава, неизвестна.
В этой главе представлен обзор этиологии и патогенеза дисплазии тазобедренного сустава у собак, обсуждаются предложенные генетические и внешние причины заболевания, а также рентгенография тазобедренных суставов.
Этиология
Исторически ДТБС характеризовалась следующими особенностями: гиперподвижность сустава [8-11], аномальные изменения тазовой мускулатуры [12], нарушения костной и хрящевой ткани, такие как задержка окостенения головки бедренной кости [13-15], изменение состава эпифизарного хряща [16] и неконгруэнтность между вертлужной впадиной и головкой бедренной кости, приводящая к дорсовентральному подвывиху [17,18]. Что из вышеперечисленного является инициирующим фактором, по-прежнему неизвестно. В настоящее время предложены две общие этиологии: гиперподвижность тазобедренных суставов и нарушение хода эндохондрального окостенения нескольких суставов. Эти процессы не являются взаимоисключающими, так как оба способны привести к аномальным механическим условиям в тазобедренном суставе, приводящим к ОА.
И суставная капсула, и костно-хрящевая конформация тазобедренного сустава – основные факторы, способствующие стабильности тазобедренного сустава под нагрузкой и, следовательно, должны приниматься во внимание при рассмотрении основной этиологии гиперподвижности тазобедренного сустава. Круглая связка головки бедренной кости может выполнять функцию основной поддерживающей структуры тазобедренного сустава собак до месячного возраста [7], после чего суставная капсула берет на себя эту функцию. Суставная капсула берет начало от латерального края вертлужной впадины и прикрепляется к шейке бедренной кости. Прочность капсулы зависит преимущественно коллагеновых волокон и их организации, в то время как податливость обусловлена внеклеточным матриксом, состоящим из коллагена, протеогликанов, воды и эластина [19-23]. С возрастом увеличивается содержание коллагена и количество перекрестных сшивок [24], что способствует прочности и жесткости суставной капсулы. При нагрузке на нормальную суставную капсулу ее конфигурация возвращается к исходной после устранения нагрузки. При слабости капсулы кривая напряжение-деформация сдвигается вправо по сравнению с кривой для тугой капсулы, таким образом, равная нагрузка приводит к большей деформации [25]. Как результат, головка бедренной кости может смещаться вбок по отношению к вертлужной впадине, нарушая структурную целостность суставного хряща. Такое боковое и дорсальное смещение можно наблюдать в пассивном состоянии в положении дорсолатерального подвывиха. Гиперподвижность сустава также может быть обусловлена выпотом в сустав [17,26]. В суставной капсуле диспластического ТБС соотношение коллагенов III и I типов выше, чем в суставной капсуле здоровых грейхаундов [27,28]. Неизвестно, обусловлено ли это незрелостью ткани, травмой [29,30], эндокринным дисбалансом [31] или генетическими отклонениями. Эти результаты можно объяснить повреждением капсулы [32]; коллаген III типа экспрессируется после травмы тканей, а собаки, описанные в этой работе, были взрослыми, при этом некоторые были направлены на операцию эндопротезирования тазобедренного сустава, что указывает на позднюю стадию ОА [28]. Для сравнения суставных капсул собак с нестабильностью тазобедренного сустава (индекс растяжения 0,8) и без нестабильности (индекс растяжения 0,4) использовали трансмиссионную электронную микроскопию. У собаки с гиперподвижностью сустава обнаружена неоднородная группа коллагеновых волокон, в то время как у собаки без гиперподвижности коллагеновые волокна были однородными. Такие же структурные различия в коллагеновых волокнах связки головки бедренной кости наблюдались у лабрадор-ретриверов со слабыми и крепкими тазобедренными суставами. Не установлено, предшествовала ли слабость капсулы синовиту или развилась параллельно с ним, однако это считается предшественником и фактором риска развития ОА [6,20,33]. Дорсолатеральный вывих тазобедренного сустава невозможен без пассивной гиперподвижности [17]. У собак с дисплазией имеются аномальные изменения круглой связки головки бедренной кости. Изначально было показано, что у маленьких щенков с ОА от умеренной до тяжелой степени увеличивается объем этой связки [34]. Более позднее исследование по сравнению объема круглой связки головки бедренной кости и степени рентгенографических изменений, характерных для ОА, у взрослых немецких овчарок не показало различия между объемом связки головки бедренной кости в нормальных суставах и суставах с «легким» ОА (уплощенная вертлужная впадина/выраженное ослабление дорсального края, умеренное формирование остеофитов по краю вертлужной впадины, закругленная головка бедренной кости и минимальное формирование остеофитов на шейке бедренной кости) [35]. Между тяжестью рентгенографических изменений, характерных для ОА, и объемом круглой связки головки бедренной кости существует обратная зависимость [35].
Ко второй общей этиологической категории ДТБС относится аномальное эндохондральное окостенение. Развивающийся тазобедренный сустав состоит из двух суставных поверхностей: проксимального хрящевого эпифиза головки бедренной кости (включая эпифизарный комплекс, область, где находится вторичный центр окостенения и зона роста) и вертлужной впадины (рис. 104-1).
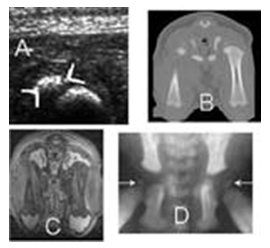
Рис. 104-1. A. Ультразвуковое изображение вторичного центра окостенения головки бедренной кости у новорожденного щенка. В. Компьютерно-томографическое изображение таза 2-недельного щенка. С. МРТ-изображение таза и бедренной кости 2-недельного щенка при дорсолатеральном подвывихе. D. Рентгеновский снимок таза 2-недельного щенка в вентродорсальной проекции. Стрелками показаны вторичные центры окостенения головок бедренной кости. (Любезно предоставлено WSVandenBurgFoels, Bioengineering, Корнельский Университет).
В развивающейся вертлужной впадине существует четыре зачатка, дающих начало подвздошной, седалищной, лонной костям и кости вертлужной впадины; все они участвуют в формировании зрелой вертлужной впадины. Каждый зачаток имеет первичный центр окостенения и зону роста, благодаря чему каждый зачаток растет в направлении от центра вертлужной впадины. Подвздошная, седалищная и лонная кости имеют общий эпифиз, в котором располагается первичный центр окостенения вертлужной впадины. По мере обызвествления центры роста ограничиваются дном вертлужной впадины, образуя форму перевернутой буквы Y в боковой проекции, так называемая трехлучевая зона роста. Зачаток вертлужной впадины окостеневает между двумя вентральными плечами зоны роста, и перед закрытием трехлучевой зоны роста развивается вторичный центр окостенения в общем эпифизе. По рентгенографическим признакам, закрытие этой зоны роста у собак от среднего до крупного размера происходит в возрасте 4-5 месяцев, в то время как зона роста головки закрывается в возрасте от 9 до 11 месяцев. В диспластических тазобедренных суставах это закрытие происходит с задержкой [15]. Для нормального формирования и конформации тазобедренного сустава необходимы нормальный контакт, нагрузка и конгруэнтность между головкой бедренной кости и вертлужной впадиной. Об этом говорит успешное использование строп поддержки тазового отдела для лечения дисплазии тазобедренного сустава у людей. При ДТБС такой контакт нарушается.
Тазобедренные суставы собак с генетической предрасположенностью к ДТБС выглядят нормальными при рождении, однако в первые недели жизни происходят изменения. Неизвестно, предшествует ли гиперподвижность сустава несоответствию костных поверхностей или наоборот. По мере созревания тазобедренного сустава вторичные центры окостенения, головка бедренной кости и зоны роста вертлужной впадины становятся очевидны гистологически и видимыми при УЗИ, рентгенографии, КТ и МРТ (рис. 104-1). Любое смещение головки бедренной кости влияет на направление, силу и распределение результирующей силы, действующей на головку бедренной кости [36], приводя к задержке развития краниодорсального края вертлужной впадины [37]. Кроме того, окостенение хрящевых эпифизов головки бедренной кости при дисплазии происходит позднее, чем в нормальных тазобедренных суставах [13,15]. Вероятно, что эта ранняя неонатальная стадия развития имеет решающее значение для развития тазобедренного сустава, и даже незначительные изменения механической среды и последовательности экспрессии генов приводят к долговременным вредоносным последствиям [38]. Возможно, серия исследований методами визуальной диагностики на этой ранней стадии развития даст ключ к ранней диагностике ДТБС.
Эпизоотология и патогенез
Распространенность дисплазии тазобедренных суставов у собак в одной из университетских ветеринарных клиник в США составила 19,7% у чистопородных собак и 17,7% у метисов. Значимых различий в распространенности ДТБС в зависимости от пола, а также между чистопородными собаками и метисами не обнаружено [39]. В публикациях университетских ветеринарных клиник сообщается о четырех породах, у которых отмечен повышенный риск ДТБС по сравнению с метисами; это бернская горная собака, немецкий жесткошерстный пойнтер, кувас и ньюфаундленд [40]. Дисплазия тазобедренного сустава возможна у собак любых пород, однако чаще всего встречается у крупных собак [41-46]. Распространенность ДТБС у отдельных пород по данным OFA составляет от 1 до 75% (www.offa.org/hipstatbreed.html). Возможно, эта оценка занижена, так как вероятность предоставления снимков здоровых собак в целях сертификации выше, чем снимков собак с дисплазией, что вносит систематическую погрешность в базу данных.
Возраст выявления ДТБС по клиническим признакам зависит от тяжести болезни и внимательности владельца. Часто у собак с дисплазией изменяется походка и/или появляется хромота в период роста (в возрасте от 3 до 8 месяцев). Клиническое обследование с пальпацией и рентгенографией может показать подвывих тазобедренного сустава (суставов). При наличии подвывиха всегда присутствуют синовит, утолщение суставной капсулы и повреждение суставного хряща. При дисплазии тазобедренных суставов описаны изменения хряща и мягких тканей, характерные для ОА [47,48]. Сначала повреждение хряща появляется вокруг впадины, что говорит об усилении локальной нагрузки на эту зону в результате аномальных изменений направления или силы нагрузок [47,49]. В результате появляется болезненность сустава, дегенерация суставного хряща и ремоделирование кости, характерное для OA (рис. 104-2). Так как аномальные нагрузки при опоре по-прежнему способствуют чрезмерному износу суставного хряща, повреждается также нижележащая костная ткань, что, возможно, приводит к образованию болезненных микротрещин и склерозу. В молодом возрасте повреждения хряща вокруг ямки сопровождается повышением плотности субхондральной костной ткани и головки бедренной кости [50]. По мере взросления животного гиперподвижность сустава снижается, капсула подвергается фиброзу, а выпот в суставе исчезает.
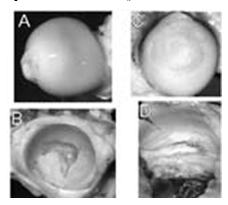
Рис. 104-2. A. Дорсальная поверхность нормальной головки бедренной кости у собаки. В. Боковая часть нормальной вертлужной впадины у собаки. С. Медиальная поверхность головки бедренной кости у 18-месячной собаки с эрозией суставного хряща на всю толщину и разрушением круглой связки головки бедренной кости. D. Боковая часть вертлужной впадины той же собаки, что и на рис. C, с вторичным OA в результате дисплазии тазобедренного сустава.
Остеоартрит сохраняется; это инвалидизирующее хроническое состояние характеризуется разрушением суставного хряща, фиброзом, ремоделированием костной ткани и, в конечном итоге, потерей функции. У некоторых собак рентгенографические признаки ОА становятся очевидны уже в возрасте 5-9 месяцев, в то время как у других они не проявляются до 2 лет и более [51]. Ранние характерные для ОА изменения, такие как синовит, частичные или полные разрывы связки головки бедренной кости и изменения суставного хряща, частичные или на всю толщину, не видны на рентгеновских снимках (рис. 104-2) [5,52,53]. Непосредственная артроскопическая оценка тазобедренного сустава у собак после тройной остеотомии таза показала, что признаки ОА на рентгеновских снимках тазобедренного сустава с вытянутыми конечностями видны всего у 50% собак с артроскопическими изменениями 2-3 степени (разволокнение поверхности суставного хряща и глубокие трещины, соответственно)[52].
Генетика
Развитие ДТБС обусловлено двумя основными факторами: генетикой и окружающей средой. Фенотип собаки – результат сложного взаимодействия между ее генотипом и действующими на нее внешними условиями [18,37,54-56].
Дисплазия тазобедренных суставов у собак считается количественно наследуемым, сложным, полигенным или многофакторным заболеванием, приводящим к ОА тазобедренных суставов. Наследуемые количественно генетические признаки варьируют в непрерывном диапазоне от индивида к индивиду, и, кроме факторов окружающей среды, на них влияют два или более генов [18]. Между фенотипическими проявлениями и популяционной генетикой отмечена умеренная положительная корреляция (0,24) [57], при этом оценка наследуемости симптомов подвывиха наивысшая [58]. У более крупных пород отмечается общая тенденция к наследованию ДТБС и ОА тазобедренного сустава, тем не менее, у многих собак с генетической восприимчивостью клинический фенотип не проявляется [46]. Оценка наследуемости (h2) ДТБС варьирует в зависимости от авторов и исследуемой популяции. На основании исследований с рентгенографической оценкой, коэффициент наследуемости ДТБС составляет 0,1-0,68 [41,45,46,55,57-62]. Материнский эффект аддитивный (hm2 (аддитивный генетический материнский эффект) = 0,1 +/- 0,02) [60], оценки состояния тазобедренных суставов суки и кобеля значительно влияют на оценку конформации у потомства [63]. Значимых различий в конформации тазобедренных суставов потомков в зависимости от пола, а также принадлежности к чистой или смешанной породе, не обнаружено [39]. Чем выше показатель наследуемости, тем выше вероятность фенотипических улучшений при использовании программ избирательного разведения.
С помощью генетической селекции удалось улучшить фенотип в контролируемых популяциях, например, Seeing Eye Inc., Морристаун, Нью-Джерси; племенную ценность животных оценивали по индивидуальным фенотипам в сочетании с информацией о родителях и потомстве [55]. Один из лучших описанных показателей генетического улучшения – значение, равное одному стандартному отклонению за 10-летний период в Финляндии [57]. Программы отбора с помощью открытых реестров, например, в Швеции, привели к улучшению качества тазобедренных суставов [62], однако в других странах [44,64-66] фенотипические улучшения были минимальны. Так как у ДТБС полигенный характер наследования, будущие усилия по контролю заболевания с помощью тестов, основанных на одиночном генетическом маркере, не приведут к немедленному результату [67], за исключением ситуации, когда обнаружен основной способствующий локус, мутации в котором приводят к проявлению ДТБС. Судя по текущему уровню знаний молекулярной генетики, это представляется маловероятным.
Тип наследования говорит о том, что ДТБС контролируется несколькими генами в локусах количественных признаков (ЛКП), на экспрессию которых влияют внешние факторы. Возможно, существуют индуцирующие или защитные ЛКП, контролирующие экспрессию признаков ОА тазобедренного сустава, независимо от контролирующих диспластический фенотип [68,69]. По-видимому, некоторые породы отличаются от других своей восприимчивостью к ДТБС на основании индексов растяжения и способны переносить большую степень пассивной гиперподвижности сустава, чем другие [70,71]. У некоторых пород рентгенографические признаки ОА тазобедренного сустава в результате предшествующей ДТБС могут развиться быстрее, чем у остальных [70]. С помощью статистических моделей установлено, что у немецких овчарок, золотистых ретриверов, лабрадор-ретриверов, ротвейлеров и метисов грейхаунда и лабрадор-ретривера с дисплазией развитие ДТБС определяет основной локус [55,72,73]. При исследовании португальских водяных собак для идентификации ЛКП, регулирующего ДТБС, обнаружено два отдельных ЛКП, оба расположенные на 1 хромосоме и разделенные примерно 95 млн. п.о., один из которых связан с углом Норберга каждого тазобедренного сустава и обусловливает до 16% фенотипической вариабельности. Полагают, что основной локус способствует фенотипической вариабельности на 20%, таким образом, данные молекулярной и популяционной генетики в настоящее время не согласуются [74]. Интересно отметить, что какая-либо асимметрия подвывиха на рентгеновских снимках с вытянутыми конечностями не наследовалась [74]. Аллели, вносящие вклад в сложные наследуемые признаки, такие как ДТБС, могут быть доминантными или аддитивными. Выраженность их эффекта не зависит от типа наследования [75].
Окружающая среда
На развитие и тяжесть дисплазии тазобедренных суставов у генетически предрасположенных собак влияют многие негенетические и/или внешние факторы. Показано, что ни один из них не вызывает ДТБС у собак без генетической предрасположенности. Считается, что на развитие и клинические симптомы ДТБС влияют такие факторы, как размер тела, скорость роста, сезон рождения, питание, анионный интервал рациона, воздействие гормонов inutero и мышечная масса [18,33]. Высокое потребление калорий, чрезмерное потребление белка и кальция, быстрый рост, отсутствие или недостаток физических нагрузок – все это повышает тяжесть ДТБС [18,37,54,55].
Эффекты, связанные с матерью/пометом
Гормоны и пептиды, способствующие росту, такие как инсулин, кортизол, эпидермальный фактор роста, инсулиноподобный фактор роста (ИФР), пептид, родственный паратиреоидному гормону, релаксин, эстроген и предшественники эстрогена, присутствуют в молозиве и молоке сук [76,77]. Эти пептиды, всасываясь через желудочно-кишечный тракт, особенно в ранний постнатальный период [78], способны влиять на метаболизм соединительной ткани, особенно в генетически чувствительных тканях. Релаксин, эстроген и предшественники эстрогена в большом количестве содержатся в молоке лабрадор-ретриверов [31]. Релаксин сохраняется в сыворотке сук лабрадор-ретривера с дисплазией на протяжении всего периода лактации, однако у сук без дисплазии обнаруживается только в первые 1-2 недели лактации. Релаксин – мощный индуктор нейтральной матриксной металлопротеиназы 1 (коллагеназы 1) и 3 (стромелизин 1), а также экспрессии активатора плазминогена. Эти активированные ферменты расщепляют внеклеточный матрикс и, следовательно, влияют на структуру и метаболизм суставной капсулы и связок. Локальная активность релаксина в тканях, предварительно подвергшихся действию эстрогена, может способствовать слабости капсулы и связок при ДТБС. Концентрации общего эстрогена в сыворотке щенков, рожденных от родителей с дисплазией и без, сходны, однако тестостерон обнаружен в молоке только у сук лабрадор-ретривера с дисплазией, а эстрадиол-17β – только в сыворотке у щенков, рожденных от родителей с дисплазией. Инъекции ингибитора ароматазы (препятствующего превращению тестостерона в 17β-эстрадиол) щенкам лабрадор-ретривера, полученным от родителей с дисплазией, с рождения и на протяжении лактации значительно уменьшали гиперподвижность сустава в зрелом возрасте [79]. Соответственно, введение эстрогена в период роста может индуцировать ДТБС [2,80]. Сообщалось, что эффекты, связанные с пометом, вносят 4% вклад в вариабельность фенотипа; в этот процент входят все внешние и генетические эффекты, общие для членов одного помета, а также эффект породы [57]. Таким образом, по-видимому, эффект матери почти пренебрежимо мал (1,5%) [57,61].
Чрезмерное потребление корма ускоряет появление первых симптомов и способствует повышению тяжести ДТБС [34]. Хотя перекармливание само по себе не вызывает ДТБС, оно способствует максимальному проявлению этого признака у генетически восприимчивых индивидов. Частота и тяжесть ДТБС и сопутствующего ОА у пораженных щенков лабрадор-ретривера значительно снижалась при ограничении потребления корма до 25% от объема, поедаемого контрольными однопометниками, которым был предоставлен неограниченный доступ к корму [81-83]. Сокращение объема корма привело к сокращению признаков ДТБС на 67% в 2-летнем возрасте [83] и значительно снизило распространенность и тяжесть ОА тазобедренного сустава в возрасте 5 лет [82]. У собак, получавших ограниченный рацион, был значительно меньше выражен ОА тазобедренных, плечевых суставов и поясничных позвонков [81]. Одно исследование показало, что масса тела собаки при рождении – важный фактор, определяющий возраст окостенения головки бедренной кости, а также гиперподвижность незрелого сустава; у собак с большей массой тела площадь покрытия головки бедренной кости была меньше [38]. Механизм такого влияния питания остается неизвестным, однако это можно объяснить с точки зрения механики (максимальное ускорение роста создает максимальные нагрузки на генетически восприимчивые тазобедренные суставы), либо с точки зрения влияния компонентов корма на локальную экспрессию генов. Меньшая масса тела (т. е. ограниченное кормление) замедляет развитие и ограничивает тяжесть рентгенографических признаков ОА [81-83]. Питание в перинатальный период может иметь долговременные последствия для метаболизма. Искусственное вскармливание щенков, предрасположенных к ДТБС, после кесарева сечения приводило к замедлению роста и меньшей частоте проявления признака по сравнению с естественным вскармливанием. Неограниченное кормление догов индуцировало экспрессию генов, обусловливающих несколько нежелательных ортопедических нарушений, в том числе ДТБС, в сравнении с собаками, получавшими ограниченные порции корма [43]. Также предполагалось, что чрезмерные физические нагрузки у собак со значительной гиперподвижностью суставов могут с высокой вероятностью вызвать или усугубить ДТБС, однако научных доказательств этого предположения не получено [84].
Кроме ограничения кормления, единственным средством лечения, способным значительно снизить проявления ОА тазобедренного сустава при ДТБС, является системное введение полисульфированного гликозаминогликана (Адекван), эффективность которого была показана на лабрадор-ретриверах, склонных к дисплазии, в возрасте с 6 недель до 8 месяцев [85]. Полисульфированные гликозаминогликаны – ингибиторы активности нейтральной матриксной металлопротеиназы, а также значительно уменьшают расслабление тазового симфиза у морских свинок, которым предварительно вводили эстроген [86].
Во многих крупномасштабных исследованиях предпринимались попытки оценить факторы окружающей среды, влияющие на частоту экспрессии ДТБС. Одно из исследований на ротвейлерах в Финляндии (n=2764) показало, что внешними условиями, влияющими на ДТБС, были возраст (чем старше собака, тем хуже состояние), год рождения (1998 лучшее состояние, 1995 худшее состояние), взаимодействие между годом рождения и сезоном (сезон сам по себе не был фактором в других исследованиях [45,59,61] и опыт ветеринара, оценивающего рентгеновские снимки собаки (однако без четких тенденций и с незначительными различиями между классами) [57]. В более недавнем исследовании на лабрадор-ретриверах и шотландских сеттерах в Великобритании средняя оценка тазобедренного сустава собак в период между июнем и октябрем была ниже, чем у собак, родившихся в остальное время года. Эти результаты сходны с полученными Hanssen 1991 и Olerth et al. 2001 [87]. Одна из гипотез, объясняющих этот эффект, заключается в том, что собаки, родившиеся в более теплый сезон, могли бегать по мягкой земле, что способствовало развитию поддерживающей мускулатуры и профилактике ДТБС [88]. Возможно, на результаты, связанные с сезоном рождения, влияют многие другие факторы. Масса тела при рождении – значимый прогностический показатель возраста обызвествления проксимальной части головки (чем больше масса, тем раньше наступает обызвествление) и подвывиха головки бедренной кости в 4 месяца (чем больше вес при рождении, тем меньше покрытие в положении дорсолатерального подвывиха) [38].
При попытках установить, влияет ли возраст на проявление ДТБС, результаты исследований не согласуются. Сообщалось о повышенной частоте как у сук [1,62], так и у кобелей [59], а также о равном половом распределении [71,89]. Следовательно, неизвестно, является ли влияние пола прямым эффектом экспрессии генов половых хромосом, либо результатом вторичных эффектов пола (гормонов, веса) [62]. Половой цикл сук значительно не влияет на гиперподвижность тазобедренного сустава, измеряемую по индексу растяжения [90].
Диагностика
Чаще всего с ДТБС поступают собаки двух возрастов: щенки в возрасте от 5 до 9 месяцев или зрелые взрослые собаки. Уже в 16 недель гиперподвижность сустава, определяемая по индексу растяжения, указывает на риск ОА [71]. Наиболее распространенные изменения при клиническом осмотре молодых собак с ДТБС включают дискомфорт при вытягивании или отведении бедра и/или положительный симптом Ортолани. У 6-месячных щенков угол репозиции воспроизводим, то есть этот тест могут проводить разные исследователи со сравнимыми и постоянными результатами [91]. Полагают, что положительный симптом Ортолани является фактором риска развития ОА в последующем, однако значимость его наличия или отсутствия в долговременной перспективе не оценивалась [49]. По мере старения собаки с субклинической хромотой в результате ОА тазобедренного сустава начинают компенсировать ее за счет переноса веса тела между парами конечностей, движущихся синхронно при рыси, а не между тазовыми и грудными конечностями [92]. По мере усиления боли в результате хронического ОА эффекты лучше всего может оценить владелец или человек, хорошо знакомый с собакой, после обучения распознаванию клинических признаков заболевания [93].
Профилактика и рентгеновские снимки
Рентгенография – наиболее распространенный инструмент для диагностики ДТБС, который также очень информативен для оценки вероятности развития ДТБС у щенков. Несколько техник рентгенографии активно исследовались для установления их чувствительности и специфичности для прогнозирования развития рентгенографических, клинических или гистологических признаков ДТБС. Проблема с любыми рентгенографическими техниками заключается в том, что фенотип собаки не является гарантией ее генотипа. Большая часть опубликованной информации противоречива или не поддается сравнению из-за разных сценариев исследований и конечных критериев оценки. Мы приведем обзор разных рентгенографических техник и показаний к ним.
Описано несколько рентгенографических симптомов ДТБС, появляющихся первыми. В 1973 г описан подвывих головки бедренной кости и задержка развития края вертлужной впадины уже в 2-9 месяцев [37]; сообщалось, что задержка окостенения головки бедренной кости является самым ранним рентгенографическим прогностическим показателем ДТБС в популяции [13,15]. Более поздние характерные для ОА изменения, связанные с ДТБС, включают субхондральный склероз, остеофиты, деформацию сустава, пролиферативные и литические изменения в местах прикрепления суставной капсулы и поддерживающих связок, а также внутрисуставные фрагменты [94-96]. Рентгенографические признаки ОА могут появиться в возрасте 5-9 месяцев, однако некоторые из них не видны по меньшей мере до 24 месяцев или более [51].
Все имеющиеся рентгенографические тесты считаются неточными в возрасте до 4 месяцев включительно, вероятнее всего, из-за продолжающегося эндохондрального окостенения и сложности визуализации хряща стандартными рентгенографическими техниками [9,11,15,97]. Диагностические методы дают более точные результаты в возрасте от 8 месяцев [9,11,15,97,98], когда тазобедренные суставы полностью зрелые и период быстрого роста завершился [99]. При оценке рентгеновских снимков любой собаки на ДТБС необходимо помнить, что не у всех собак с рентгенографическими признаками подвывиха развиваются рентгенографические изменения, характерные для ОА, к 2-летнему возрасту [97].
Рентгеновские снимки с вытянутыми бедрами
Рентгеновские снимки с вытянутыми бедрами часто используются для проверки на ДТБС (рис. 104-3). Они делаются в положении собаки на спине, обычно под глубокой седацией. Бедра вытягивают параллельно поверхности стола и друг другу, а коленные суставы разгибают и поворачивают так, чтобы коленные чашки располагались по центру желобов блока. Организация ветеринарной ортопедии (OFA, www.offa.org) использует эту проекцию для оценки ДТБС. Рентгеновские снимки позволяют установить наличие ОА, его тяжесть и определенные степени подвывиха. Оценка по рентгеновским снимкам с вытянутыми конечностями в возрасте до 2 лет считается предварительной, так как у более молодых больных собак может не быть рентгенографических признаков подвывиха при съемке в вытянутом положении [11,33]. Результаты дают основания полагать, что специфичность – сильная сторона рентгенографии с вытянутыми бедрами в возрасте 8 месяцев [98]. Общепринято, что метод оценки тазобедренных суставов OFA самый специфичный (96%) [53], однако дает заниженную оценку восприимчивости к ДТБС [100]. Smith et al. (1995) обнаружили, что угол Норберга, определенный по рентгеновским снимкам с вытянутыми бедрами, не является значимым фактором риска последующего развития изменений, характерных для OA [71].
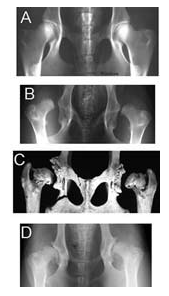
Рис. 104-3. A. Вентродорсальный рентгеновский снимок таза собаки с правильной конформацией тазобедренного сустава. В. Вентродорсальный рентгеновский снимок таза собаки с тяжелой дисплазией тазобедренного сустава. С. Отпрепарированные тазобедренные суставы старой собаки с сильным ремоделированием, характерным для ОА, прогрессировавшего до дисплазии ТБС. D. Вентродорсальный рентгеновский снимок таза собаки с ОА на фоне дисплазии.
В том числе обнаружено, что каудолатеральные криволинейные остеофиты (ККО) на снимках с вытянутыми конечностями позволяют прогнозировать развитие ОА в последующем. Они были впервые обнаружены в 1961 году и развиваются в месте прикрепления суставной капсулы с шейкой бедренной кости [101]. Значимость этого изменения под вопросом [7,96,102-104], так как часто оно присутствует без каких-либо других признаков ОА, что заставляет сомневаться в его роли как раннего признака последующего развития ОА [84]. Это необходимо дифференцировать от так называемой «щенячьей линии», сходной с ККО, но, как полагают, не являющейся патологическим изменением [84]. Щенячья линия обнаруживается у собак в возрасте до 18 месяцев, а затем исчезает, либо трансформируется в ККО [105]. Статистической связи между щенячьей линией и последующим развитием ОА не обнаружено. Исходная гипотеза заключалась в том, что ККО развивается вторично в результате усиления нагрузки на место прикрепления суставной капсулы у собак с чрезмерной гиперподвижностью сустава [96]. Другие исследования показали зависимость между ККО и последующим развитием ОА у лабрадор-ретриверов. У собак с ККО вероятность рентгенографических признаков ОА была в 3,7 раз выше, чем у собак без ККО [105]. ККО был первым рентгенографическим симптомом у 76% собак, у которых в последующем развились рентгенографические признаки ОА, и 95% собак с гистологическими признаками ОА имели ККО [105]. Еще одно исследование показало, что у собак с ККО в 7,9 раз выше вероятность рентгенографических признаков ОА, чем у собак без ККО. Индекс растяжения, вес и возраст животного – значимые факторы риска ККО [84], однако эта временная связь не является окончательным прогностическим показателем развития ОА. При оценке ККО в зависимости от кормления (группа с неограниченным доступом к корму и группа, которую кормили ограниченными порциями) было обнаружено, что у 100% контрольных собак с ККО и 55% собак с ККО, получавших ограниченные порции, в последующем развились рентгенографические признаки ОА [105]. Независимо от группы кормления, вероятность развития признаков ОА или ККО у собак с «щенячьей линией» была не выше, чем у собак без такой линии. Рацион не влиял на частоту ККО, только на время их возникновения. Возможно, это говорит о том, что ККО – более чувствительный рентгенографический маркер восприимчивости к ОА, на оценку которого не влияют внешние факторы, такие как ограниченное кормление [105].
Индекс растяжения (PennHip) и оценка дорсолатерального подвывиха
Индекс растяжения (ИР) (рис. 104-4A) и оценка дорсолатерального подвывиха (ОДП) (рис. 104-4B) – меры гиперподвижности сустава. ИР также измеряется в положении на спине. Для рентгенографии с целью определения ИР тазобедренные суставы сгибают, чтобы коленные чашки были обращены к потолку. На тазобедренные суставы между бедрами накладывают специально изготовленное выравнивающее устройство и прилагают к коленным суставам силу, направленную внутрь, для определения степени гиперподвижности тазобедренного сустава. ИР вычисляют как разницу между этими снимками и используют для прогнозирования вероятности развития ДТБС. Для каждой породы можно установить свои кривые логистической регрессии, чтобы сопоставить ИР с наличием ОА в результате ДТБС. Для выполнения этой техники оператор должен пройти специальное обучение и отправить снимки для оценки. Однако этот метод гарантирует полный учет без систематической погрешности. Кроме того, ИР можно увеличить искусственно за счет увеличения объема внутрисуставного пространства, а также полостей, без изменения результата ОДП [17,106]. Снимки в проекции для ОДП также делают под глубокой седацией или наркозом. Животное укладывают на грудь на подстилку с вырезами для тазовых конечностей, так, чтобы коленные суставы были согнуты и поддерживали вес. Тазобедренные суставы располагают по центру рентгеновского снимка, чтобы оценить их конформацию при опоре. Преимуществом ОДП является простота выполнения; для этого метода необходим только один рентгеновский снимок, который можно сделать под наркозом или седацией, и оператору не требуется держать собаку во время рентгенографии. Метод и измерения воспроизводимы [49]. Внешние факторы, такие как дорсальная нагрузка на тазобедренный сустав, а также проведение исследования под наркозом или глубокой седацией, не оказывают заметного клинического влияния на ОДП, хотя нагрузка на тазобедренные суставы увеличивает оценку ОДП у некоторых метисов [107]. 6% изменение оценки ОДП в суставе под нагрузкой и без статистически значимо, но вряд ли значимо клинически [107]. ОДП – это объективная мера подвывиха тазобедренного сустава, в то время как оценка OFA субъективна.
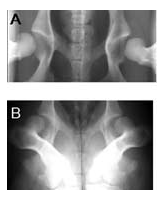
Рис. 104-4. A. Вентродорсальный рентгеновский снимок таза собаки в растянутом положении (PennHip). B. Дорсовентральный рентгеновский снимок таза собаки в положении дорсолатерального подвывиха. У обеих собак гиперподвижность тазобедренного сустава, а у собаки на снимке 4B – дисплазия и подвывих тазобедренного сустава.
Оценки ИР и ОДП связаны, однако, вероятно, отражают определенные свойства структуры тазобедренного сустава и являются мерами разных компонентов стабильности сустава [17]. Результаты нескольких исследований говорят, что оценки ИР и ОДП остаются постоянными после 8-месячного возраста [9,18,98]. В зрелом тазобедренном суставе гиперподвижность (ИР) может измениться независимо от результата ОДП [17]. Использование ИР, либо ОДП облегчает обнаружение легких случаев ДТБС по сравнению с оценкой снимков с вытянутыми конечностями. Специфичность ОДП для прогнозирования ОА тазобедренного сустава у лабрадор-ретриверов, грейхаундов и их метисов в возрасте 8 месяцев (84%, ОДП < 55%) сходна с ИР (89%, ИР > 0,7) [73]. Чувствительность ОДП представляется выше, чем у ИР: в зависимости от используемого граничного значения для ИР (> 0,7) и ОДП (< 55%), чувствительность первого метода равна 50%, а второго – 83%. Собаки с оценками ОДП менее 42% в возрасте 8 месяцев страдали от ОА тазобедренного сустава в молодом зрелом возрасте, в то время как у собак с оценкой более 55% была высока вероятность нормальных тазобедренных суставов. По нашему мнению, ОДП представляет собой оценку конформации тазобедренного сустава, независимую от пассивной гиперподвижности, тем не менее, обе оценки важны для прогнозирования последующего развития ОА [49,108].
В нескольких исследованиях сравнивались различные рентгенографические техники с разными конечными точками - рентгенографическими признаками ОА, макроскопическими изменениями при вскрытии и гистологическими признаками ОА. В одном из таких исследований сравнивали рентгеновские снимки с вытянутыми бедрами, ИР и ОДП в 8-месячном возрасте, а конечным критерием оценки служили макроскопические изменения при вскрытии. Все рентгенографические изменения значительно коррелировали с макроскопическими изменениями при вскрытии. Специфичность всех трех методов была сходной, однако ОДП характеризовалась большей чувствительностью и, следовательно, меньшим числом ложноотрицательных результатов [96]. Еще в одном более недавнем исследовании сравнивали рентгенографические изменения у 8-месячных щенков с макроскопическими изменениями при вскрытии. В частности, оценивались такие параметры, как рентгеновские снимки с вытянутыми бедрами, ИР, ОДП и угол Норберга (УН). ОДП и УН лучше всего позволяли дифференцировать нормальные суставы от суставов, пораженных ОА, и все модели, из которых была исключена оценка ОДП, уступали содержащим эту оценку. Выводы из этого исследования дают основания полагать, что два метода лучше чем один, особенно если один из них – это ОДП, однако добавление третьего метода не дает дополнительных преимуществ для оценки ДТБС [109].
Лечение и прогноз
Обычно при ДТБС рекомендуют два варианта лечения: медикаментозное и хирургическое. Хирургическое лечение заключается в симфизиодезе в молодом возрасте, тройной остеотомии таза, резекционной артропластике или полном эндопротезировании тазобедренного сустава. Эти методы обсуждаются в других источниках. Медикаментозное лечение многогранно и заключается в превентивных мерах, которые начинают в молодом возрасте, и лечении, направленном на замедление прогрессирования и облегчение клинических признаков ОА в последующем.
Две основные профилактические меры, которые можно принять для собаки с генетической предрасположенностью к ДТБС – введение системных полисульфированных гликозаминогилканов (ПСГАГ) и ограничение кормления. Системное введение ПСГАГ в дозе 5 мг/кг в период роста способно значительно замедлить прогрессирование ДТБС и облегчить вторичный ОА у восприимчивых собак [85]. У собак с тяжелым ОА в результате ДТБС не обнаружено статистически значимых различий между группами лечения ПСГАГ при трех дозах или плацебо. Авторы приписали это отсутствию ответа, либо тому, что ответ слишком слабо выражен, чтобы обнаружить его при клиническом осмотре для установления эффективности [110]. ПСГАГ обладают хондропротективным действием при профилактическом или терапевтическом применении [111-118]. Полисульфированный гликозаминогликан (Адексан®) получают из тканей легких и трахеи крупного рогатого скота, и он структурно сходен с гликозаминогликанами, содержащимися в гиалиновом хряще [119,120]. Invitro ПСГАГ способны замедлять распад коллагена и гликозаминогликанов [121-123]. Результаты других исследований invitro дают основания полагать, что лечение ПСГАГ может изменить ход прогрессирования ОА в суставном хряще за счет поддержания жизнеспособности хондроцитов, а также защиты внеклеточного матрикса от деградации [124]. После внутримышечного и внутрисуставного введения концентрации ПСГАГ в сыворотке и суставах сходны [125]. Еще один метод уменьшения тяжести ДТБС заключается в ограничении кормления с 8-недельного возраста. Уменьшение потребления корма на 25% по сравнению с контрольными животными, получавшими корм неограниченно, приводило к 67% уменьшению выраженности ДТБС в 2-летнем возрасте и значительно снижало распространенность и тяжесть ОА тазобедренного сустава к 5-летнему возрасту [82]. Кроме того, у собак, получавших ограниченное кормление, реже встречался остеоартрит нескольких суставов [81]. Владельцам собак с ОА в результате ДТБС можно дать несколько рекомендаций: снижение веса до идеального для данной породы, если у животного избыточный вес; умеренные физические нагрузки, способствующие развитию поддерживающей мышечной массы в области тазобедренных суставов; и применение нестероидных противовоспалительных препаратов, если животное нормально переносит их. Кроме того, рекомендуются добавки, содержащие глюкозамин и хондроитина сульфат, либо инъекции ПСГАГ, особенно для более молодых собак. Внимательное применение любого метода выявления ДТБС в сочетании с проверкой потомства представляется настолько же важной мерой снижения частоты этого заболевания, как и само исследование тазобедренного сустава. Допуск к разведению только животных с лучшим состоянием тазобедренных суставов, чем в среднем по породе, не приведет к искоренению заболевания [65]. Пока нет методов генетической проверки, лучшим показателем генетики собаки является фенотип ее родителей и их родителей, потомства и однопометников, а также полусибсов. Планирующим покупку щенка следует запросить у заводчика информацию о фенотипе родственников щенка. В конечном итоге, лучшим способом искоренения наследственного нарушения из породы является знание связанных генетических маркеров и, в конечном итоге, мутаций в основных локусах, обусловливающих заболевание у данной породы. На основании этого можно проводить генетический отбор щенков перед покупкой и использованием для разведения, а также принимать осознанные решения относительно программ разведения.
Литература
1. Hedhammar A, Olsson SE, Andersson SA, et al. Canine hip dysplasia: Study of heritability in 401 litters of German shepherd dogs. J Am Vet Med Assoc 174:1012, 1979. - PubMed -
2. Henricson B, Norberg I, Olsson SE. On the etiology and pathogenesis of hip dysplasia: A comparative review. J Small Anim Pract 7:673, 1966. - PubMed -
3. Hutt FB. Genetic selection to reduce the incidence of hip dysplasia in dogs. J Am Vet Med Assoc 151:1041, 1967.
4. Mansson J, Norberg I. Dysplasia of the hip in dogs. Hormonally induced flaccidity of the ligaments followed by dysplasia of the acetabulum in puppies. Medlemsbl Sverig Vet Forb 13:330, 1961.
5. Riser WH. The dysplastic hip joint: Its radiographic and histologic development. J Am Vet Radiol Soc 14:35, 1973.
6. Smith GK, Biery DN, Kapatkin AS, et al. Question diagnostic technique for hip dysplasia. J Am Vet Med Assoc 220:20, 2002. - PubMed -
7. Riser WH. The dog as a model for the study of hip dysplasia. Growth, form, and development of the normal and dysplastic hip joint. Vet Pathol 12:234, 1975. - PubMed -
8. Alexander JW. The pathogenesis of canine hip dysplasia. Vet Clin North Am Small Anim Pract 22:503, 1992. - PubMed -
9. Lust G, Williams AJ, Burton-Wurster N, et al. Joint laxity and its association with hip dysplasia in Labrador retrievers. Am J Vet Res 54:1990, 1993. - PubMed -
10. Smith GK, Biery DN, Gregor TP. New concepts of coxofemoral joint stability and the development of a clinical stress-radiographic method for quantitating hip joint laxity in the dog. J Am Vet Med Assoc 196:59, 1990. - PubMed -
11. Smith GK, Gregor TP, Rhodes WH, et al. Coxofemoral joint laxity from distraction radiography and its contemporaneous and prospective correlation with laxity, subjective score, and evidence of degenerative joint disease from conventional hip-extended radiography in dogs. Am J Vet Res 54:1021, 1993. - PubMed -
12. Cardinet GH 3rd, Kass PH, Wallace LJ, et al. Association between pelvic muscle mass and canine hip dysplasia. J Am Vet Med Assoc 210:1466, 1997. - PubMed -
13. Madsen JS, Reimann I, Svalastoga E. Delayed ossification of the femoral head in dogs with hip dysplasia. J Small Anim Pract 32:351, 1991.
14. Todhunter RJ, Acland GM, Olivier M, et al. An outcrossed canine pedigree for linkage analysis of hip dysplasia. J Hered 90:83, 1999. - PubMed -
15. Todhunter RJ, Zachos TA, Gilbert RO, et al. Onset of epiphyseal mineralization and growth plate closure in radiographically normal and dysplastic Labrador retrievers. J Am Vet Med Assoc 210:1458, 1997. - PubMed -
16. Todhunter RJ, Burton-Wurster N, Vernier-Singer M, et al. Composition of Labrador retriever chondroepiphyses. In: Proceedings of the Ann Meet Am Coll Vety Surg 1998.
17. Farese JP, Lust G, Williams AJ, et al. Comparison of measurements of dorsolateral subluxation of the femoral head and maximal passive laxity for evaluation of the coxofemoral joint in dogs. Am J Vet Res 60:1571, 1999. - PubMed -
18. Lust G. An overview of the pathogenesis of canine hip dysplasia. J Am Vet Med Assoc 210:1443, 1997. - PubMed -
19. Kleftogiannis F, Handley CJ, Campbell MA. Characterization of extracellular matrix macromolecules from bovine synovial capsule. J Orthop Res 12:365, 1994. - PubMed -
20. Parry DA, Flint MH, Gillard GC, et al. A role for glycosaminoglycans in the development of collagen fibrils. FEBS Lett 149:1, 1982. - PubMed -
21. Rosenbloom J. Elastin: An overview. Methods Enzymol 144:172, 1987. - PubMed -
22. Scott JE, Orford CR, Hughes EW. Proteoglycan-collagen arrangements in developing rat tail tendon. An electron microscopical and biochemical investigation. Biochem J 195:573, 1981. - PubMed -
23. Watanabe M, Nojima M, Shibata T, et al. Maturation-related biochemical changes in swine anterior cruciate ligament and tibialis posterior tendon. J Orthop Res 12:672, 1994. - PubMed -
24. Eyre DR, et al. Extraction, separation, and analysis of matrix constituents. In: Methods in Cartilage Research. Maroudas M, Kuettner K (eds). New York: Academic Press, 1990, p. 28. - PubMed - - Available from amazon.com -
25. Smith GK. PennHip™ training course. Philadelphia, 1994.
26. Lust G, Geary JC, Sheffy BE. Development of hip dysplasia in dogs. Am J Vet Res 34:87, 1973.
27. Madsen JS. The joint capsule and joint laxity in dogs with hip dysplasia. J Am Vet Med Assoc 210:1463, 1997. - PubMed -
28. Madsen JS, Svalastoga E. Inclination and anteversion of collum femoris in hip dysplasia and coxarthritis. Acta Vet Scand 35:115, 1994. - PubMed -
29. Bornstein P, Sage H. Structurally distinct collagen types. Annu Rev Biochem 49:957, 1980. - PubMed -
30. Epstein EH Jr. (Alpha1(3))3 human skin collagen. release by pepsin digestion and preponderance in fetal life. J Biol Chem 249:3225, 1974. - PubMed -
31. Goldsmith LT, Lust G, Steinetz BG. Transmission of relaxin from lactating bitches to their offspring via suckling. Biol Reprod 50:258, 1994. - PubMed -
32. Wiltberger H, Lust G. Ultrastructure of canine articular cartilage: Comparison of normal and degenerative (osteoarthritic) hip joints. Am J Vet Res 36:727, 1975. - PubMed -
33. Smith GK, LaFond E, Gregor TP, et al. Within- and between-examiner repeatability of distraction indices of the hip joints in dogs. Am J Vet Res 58:1076, 1997. - PubMed -
34. Lust G, Beilman WT, Rendano VT. A relationship between degree of laxity and synovial fluid volume in coxofemoral joints of dogs predisposed for hip dysplasia. Am J Vet Res 41:55, 1980.
35. Mande JD, Mbithi PMF, Mbugua SW, et al. Volume of the ligamentum capitis femoris in osteoarthritic hip joints of adult dogs. J S Afr Vet Assoc 74:11, 2003. - PubMed -
36. Weigel JP, Wasserman JF. Biomechanics of the normal and abnormal hip joint. Vet Clin North Am Small Anim Pract 22:513, 1992. - PubMed -
37. Riser WH. Canine hip dysplasia: Cause and control. J Am Vet Med Assoc 165:360, 1974.
38. Vanden Berg-Foels WS, Todhunter RJ, Schwager SJ, et al. Effect of early postnatal body weight on adult hip joint degeneration in canine developmental dysplasia of the hip. Pediatr Res 60(5):549-554, 2006. - PubMed -
39. Rettenmaier JL, Keller GG, Lattimer JC, et al. Prevalence of canine hip dysplasia in a veterinary teaching hospital population. Vet Radiol Ultrasound 43:313, 2002. - PubMed -
40. LaFond E, Breur GJ, Austin CC. Breed susceptibility for developmental orthopedic diseases in dogs. J Am Anim Hosp Assoc 38:467, 2002.
41. Breur GJ, Lust G, Todhunter RJ. Genetics of canine hip dysplasia and other orthopaedic traits. In: The Genetics of the Dog. Ruvinsky A, Sampson J (eds). Wallingford,: CABI Publishing, 2001.
42. Cardinet GH 3rd, Guffy MM, Wallace LJ, et al. Canine hip dysplasia in German shepherd dog-greyhound crossbreeds. J Am Vet Med Assoc 182:393, 1983. - PubMed -
43. Hedhammar A, Wu FM, Krook L, et al. Overnutrition and skeletal disease. an experimental study in growing Great Dane dogs. Cornell Vet 64:Suppl 5:5, 1974.
44. Kaneene JB, Mostosky UV, Padgett GA. Retrospective cohort study of changes in hip joint phenotype of dogs in the United States. J Am Vet Med Assoc 211:1542, 1997.9412680 XXX"%> - PubMed -
45. Leighton EA, Linn JM, Willham RL, et al. A genetic study of canine hip dysplasia. Am J Vet Res 38:241, 1977. - PubMed -
46. Willis MB. Hip dysplasia. In: Genetics of the Dog. Willis MB (ed). New York: Howell Book House, 1989, p. 144. - Available from amazon.com -
47. Burton-Wurster N, Farese JP, Todhunter RJ, et al. Site-specific variation in femoral head cartilage composition in dogs at high and low risk for development of osteoarthritis: Insights into cartilage degeneration. Osteoarthr Cartilage 7:486, 1999.
48. Lingaas F, Klemetsdal G. Breeding values and genetic trend for hip dysplasia in the Norwegian golden retriever population. J Anim Breed Genet 107:437, 1990.
49. Farese JP, Todhunter RJ, Lust G, et al. Dorsolateral subluxation of hip joints in dogs measured in a weight-bearing position with radiography and computed tomography. Vet Surg 27:393, 1998. - PubMed -
50. Chalmers HJ, Dykes NL, Lust G, et al. Assessment of bone mineral density of the femoral head in dogs with early osteoarthritis. Am J Vet Res 67(5):796-800, 2005. - PubMed -
51. Corley EA. Role of the orthopedic foundation for animals in the control of canine hip dysplasia. Vet Clin North Am Small Anim Pract 22:579, 1992. - PubMed -
52. Holsworth IG, Schulz KS, Kass PH, et al. Comparison of arthroscopic and radiographic abnormalities in the hip joints of juvenile dogs with hip dysplasia. J Am Vet Med Assoc 227:1087, 2005. - PubMed -
53. Lust G, Summers BA. Early, asymptomatic stage of degenerative joint disease in canine hip joints. Am J Vet Res 42:1849, 1981. - PubMed -
54. Brass W. Hip dysplasia in dogs. J Small Anim Pract 30:166, 1989.
55. Leighton EA. Genetics of canine hip dysplasia. J Am Vet Med Assoc 210:1474, 1997. - PubMed -
56. Mackenzie SA, Oltenacu EA, Leighton E. Heritability estimate for temperament scores in German shepherd dogs and its genetic correlation with hip dysplasia. Behav Genet 15:475, 1985.
57. Maki K, Liinamo AE, Ojala M. Estimates of genetic parameters for hip and elbow dysplasia in Finnish rottweilers. J Anim Sci 78:1141, 2000. - PubMed -
58. Ohlerth S, Lang J, Busato A, et al. Estimation of genetic population variables for six radiographic criteria of hip dysplasia in a colony of Labrador retrievers. Am J Vet Res 62:846, 2001. - PubMed -
59. Distl O, Grussler W, Schwarz J, et al. Analysis of environmentally-conditioned and genetic influences on the frequency of hip joint dysplasia in German shepherd dogs. Zentralbl Veterinarmed A 38:460, 1991. - PubMed -
60. Hamann H, Kirchhoff T, Distl O. Bayesian analysis of heritability of canine hip dysplasia in German shepherd dogs. J Anim Breed Genet 120:258, 2003.
61. Lingaas F, Heim P. En genetisk undersokelse av hofteleddsdysplasi i norske hunderaser. Norsk Veterinaertidsskrift 99:617, 1987.
62. Swenson L, Audell L, Hedhammar A. Prevalence and inheritance of and selection for hip dysplasia in seven breeds of dogs in Sweden and benefit:cost analysis of a screening and control program. J Am Vet Med Assoc 210:207, 1997. - PubMed -
63. Reed AL, Keller GG, Vogt DW, et al. Effect of dam and sire qualitative hip conformation scores on progeny hip conformation. J Am Vet Med Assoc 217:675, 2000. - PubMed -
64. Leppanen M, Maki K, Juga J, et al. Factors affecting hip dysplasia in German shepherd dogs in Finland: Efficacy of the current improvement programme. J Small Anim Pract 41:19, 2000. - PubMed -
65. Leppanen M, Saloniemi H. Controlling canine hip dysplasia in Finland. Prev Vet Med 42:121, 1999. - PubMed -
66. Willis MB. A review of the progress in canine hip dysplasia control in Britain. J Am Vet Med Assoc 210:1480, 1997. - PubMed -
67. Wood JL, Lakhani KH, Henley WE. An epidemiological approach to prevention and control of three common heritable diseases in canine pedigree breeds in the United Kingdom. Vet J 168:14, 2004. - PubMed -
68. Chapman K, Mustafa Z, Irven C, et al. Osteoarthritis-susceptibility locus on chromosome 11q, detected by linkage. Am J Hum Genet 65:167, 1999. - PubMed -
69. Vingsbo-Lundberg C, Nordquist N, Olofsson P, et al. Genetic control of arthritis onset, severity and chronicity in a model for rheumatoid arthritis in rats. Nat Genet 20:401, 1998. - PubMed -
70. Popovitch CA, Smith GK, Gregor TP, et al. Comparison of susceptibility for hip dysplasia between rottweilers and German shepherd dogs. J Am Vet Med Assoc 206:648, 1995. - PubMed -
71. Smith GK, Popovitch CA, Gregor TP, et al. Evaluation of risk factors for degenerative joint disease associated with hip dysplasia in dogs. J Am Vet Med Assoc 206:642, 1995. - PubMed -
72. Maki K, Janss LL, Groen AF, et al. An indication of major genes affecting hip and elbow dysplasia in four Finnish dog populations. Heredity 92:402, 2004. - PubMed -
73. Todhunter RJ, Bliss SP, Casella G, et al. Genetic structure of susceptibility traits for hip dysplasia and microsatellite informativeness of an outcrossed canine pedigree. J Hered 94:39, 2003. - PubMed -
74. Chase K, Lawler DF, Adler FR, et al. Bilaterally asymmetric effects of quantitative trait loci (QTLs): QTLs that affect laxity in the right versus left coxofemoral (hip) joints of the dog (canis familiaris). Am J Med Genet A 124:239, 2004. - PubMed -
75. Bliss S, Todhunter RJ, Quaas R, et al. Quantitative genetics of traits associated with hip dysplasia in a canine pedigree constructed by mating dysplastic Labrador retrievers with unaffected greyhounds. Am J Vet Res 63:1029, 2002. - PubMed -
76. Ballard FJ, Grbovac S, Nicholas KR, et al. Differential changes in the milk concentrations of epidermal growth factor and insulin-like growth factor-I during lactation in the tammar wallaby, macropus eugenii. Gen Comp Endocrinol 98:262, 1995. - PubMed -
77. Xu RJ. Development of the newborn GI tract and its relation to colostrum/milk intake: A review. Reprod Fertil Dev 8:35, 1996. - PubMed -
78. Xu RJ, Wang T. Gastrointestinal absorption of insulin-like growth factor-I in neonatal pigs. J Pediatr Gastroenterol Nutr 23:430, 1996. - PubMed -
79. Steinetz BG, Goldsmith LT, Lust G. Transmission of estrogen and relaxin to suckling pups via milk: a possible role of hormones in canine hip dysplasia. In: Proceedings of the Meet Endocrinol Soc 1997.
80. Beling CG, Gustafsson PO, Kasstrom H. Metabolism of estradiol in greyhounds and German shepherd dogs. an investigation with special reference to hip dysplasia. Acta Radiol Suppl 344:109, 1975. - PubMed -
81. Kealy RD, Lawler DF, Ballam JM, et al. Evaluation of the effect of limited food consumption on radiographic evidence of osteoarthritis in dogs. J Am Vet Med Assoc 217:1678, 2000. - PubMed -
82. Kealy RD, Lawler DF, Ballam JM, et al. Five-year longitudinal study on limited food consumption and development of osteoarthritis in coxofemoral joints of dogs. J Am Vet Med Assoc 210:222, 1997. - PubMed -
83. Kealy RD, Olsson SE, Monti KL, et al. Effects of limited food consumption on the incidence of hip dysplasia in growing dogs. J Am Vet Med Assoc 201:857, 1992. - PubMed -
84. Mayhew PD, McKelvie PJ, Biery DN, et al. Evaluation of a radiographic caudolateral curvilinear osteophyte on the femoral neck and its relationship to degenerative joint disease and distraction index in dogs. J Am Vet Med Assoc 220:472, 2002. - PubMed -
85. Lust G, Williams AJ, Burton-Wurster N, et al. Effects of intramuscular administration of glycosaminoglycan polysulfates on signs of incipient hip dysplasia in growing pups. Am J Vet Res 53:1836, 1992. - PubMed -
86. Steinetz BG, Lust G. Inhibition of relaxin-induced pubic symphyseal "relaxation" in guinea pigs by glycosaminoglycan polysulfates and pentosan polysulfate. Agents Actions 42:74, 1994. - PubMed -
87. Wood JL, Lakhani KH. Effect of month of birth on hip dysplasia in Labrador retrievers and Gordon setters. Vet Rec 152:69, 2003. - PubMed -
88. Hanssen I. Hip dysplasia in dogs in relation to their month of birth. Vet Rec 128:425, 1991. - PubMed -
89. Priester WA, Mulvihill JJ. Canine hip dysplasia: Relative risk by sex, size, and breed, and comparative aspects. J Am Vet Med Assoc 160:735, 1972.
90. Hassinger KA, Smith GK, Conzemius MC, et al. Effect of the estrus cycle on coxofemoral joint laxity. Vet Compar Orthop Traumatol 10:77, 1997.
91. Charette B, Dupuis J, Beauregard G, et al. Palpation and dorsal acetabular rim radiographic view for early detection of canine hip dysplasia. Part 1: Standardization and measurement repeatability on six-month-old dogs. Vet Compar Orthop Traumatol 14:125, 2001.
92. Kennedy S, Lee DV, Bertram JEA, et al. Gait evaluation in hip osteoarthritic and normal dogs using a serial force plate system. Vet Compar Orthop Traumatol 16:170, 2003.
93. Hielm-Bjorkman AK, Kuusela E, Liman A, et al. Evaluation of methods for assessment of pain associated with chronic osteoarthritis in dogs. J Am Vet Med Assoc 222:1552, 2003. - PubMed -
94. Carrig CB. Diagnostic imaging of osteoarthritis. Vet Clin North Am Small Anim Pract 27:777, 1997. - PubMed -
95. Martinez SA. Congenital conditions that lead to osteoarthritis in the dog. Vet Clin North Am Small Anim Pract 27:735, 1997. - PubMed -
96. Morgan JP. Canine hip dysplasia. Significance of early bony spurring. Vet Radiol 28:2, 1987.
97. Corley EA, Keller GG, Lattimer JC, et al. Reliability of early radiographic evaluations for canine hip dysplasia obtained from the standard ventrodorsal radiographic projection. J Am Vet Med Assoc 211:1142, 1997. - PubMed -
98. Lust G, Todhunter RJ, Erb HN, et al. Comparison of three radiographic methods for diagnosis of hip dysplasia in eight-month-old dogs. J Am Vet Med Assoc 219:1242, 2001. - PubMed -
99. Adams WM, Dueland RT, Meinen J, et al. Early detection of canine hip dysplasia: Comparison of two palpation and five radiographic methods. J Am Anim Hosp Assoc 34:339, 1998. - PubMed -
100. Kapatkin AS, Gregor TP, Hearon K, et al. Comparison of two radiographic techniques for evaluation of hip joint laxity in 10 breeds of dogs. J Am Vet Med Assoc 224:542, 2004. - PubMed -
101. Whittington K, Banks WC, Carlson WD. Report of panel on canine hip dysplasia. J Am Vet Assoc 139:791, 1961.
102. Ackerman N. Hip dysplasia in the afghan hound. Vet Radiol 23:88, 1982.
103. Klimt U, Tellhelm B, Fritsch R. Importance of Morgan’s line in the radiographic examination of dogs for hip dysplasia. Kleintierpraxis 37:211, 1992.
104. Torres RCS, Ferreira PM, Araujo RB, et al. Presence of Morgan’s line as an indicator of canine hip dysplasia in German shepherd dogs. Arq Bras Med Vet Zootec 51:157, 1999.
105. Powers MY, Biery DN, Lawler DE, et al. Use of the caudolateral curvilinear osteophyte as an early marker for future development of osteoarthritis associated with hip dysplasia in dogs. J Am Vet Med Assoc 225:233, 2004. - PubMed -
106. LaFond E, Smith GK, Gregor TP, et al. Synovial fluid cavitation during distraction radiography of the coxofemoral joint in dogs. J Am Vet Med Assoc 210:1294, 1997. - PubMed -
107. Todhunter RJ, Bertram JE, Smith S, et al. Effect of dorsal hip loading, sedation, and general anesthesia on the dorsolateral subluxation score in dogs. Vet Surg 32:196, 2003. - PubMed -
108. Lust G, Todhunter RJ, Erb HN, et al. Repeatability of dorsolateral subluxation scores in dogs and correlation with macroscopic appearance of hip osteoarthritis. Am J Vet Res 62:1711, 2001. - PubMed -
109. Todhunter RJ, Grohn YT, Bliss SP, et al. Evaluation of multiple radiographic predictors of cartilage lesions in the hip joints of eight-month-old dogs. Am J Vet Res 64:1472, 2003. - PubMed -
110. de Haan JJ, Goring RL, Beale BS. Evaluation of polysulfated glycosaminoglycan for the treatment of hip dysplasia in dogs. Vet Surg 23:177, 1994. - PubMed -
111. Altman RD, Dean DD, Muniz OE, et al. Prophylactic treatment of canine osteoarthritis with glycosaminoglycan polysulfuric acid ester. Arthr Rheum 32:759, 1989. - PubMed -
112. Altman RD, Dean DD, Muniz OE, et al. Therapeutic treatment of canine osteoarthritis with glycosaminoglycan polysulfuric acid ester. Arthr Rheum 32:1300, 1989. - PubMed -
113. Carreno MR, Muniz OE, Howell DS. The effect of glycosaminoglycan polysulfuric acid ester on articular cartilage in experimental osteoarthritis: Effects on morphological variables of disease severity. J Rheumatol 13:490, 1986. - PubMed -
114. Golding J, Ghosh P. Drugs for osteoarthrosis II: The effects of a glycosaminoglycan polysulphate ester (arteparon) on proteoglycan aggregation and loss from articular cartilage of immobilized rabbit knee joints. Curr Ther Res 34:67, 1983.
115. Hannan N, Ghosh P, Bellenger C, et al. Systemic administration of glycosaminoglycan polysulphate (arteparon) provides partial protection of articular cartilage from damage produced by meniscectomy in the canine. J Orthop Res 5:47, 1987. - PubMed -
116. Howell DS, Carreno MR, Pelletier JP, et al. Articular cartilage breakdown in a lapine model of osteoarthritis. action of glycosaminoglycan polysulfate ester (GAGPS) on proteoglycan degrading enzyme activity, hexuronate, and cell counts. Clin Orthop Relat Res (213):69, 1986. - PubMed -
117. Ueno R. Results of intramuscular injection of glycosamino-glycanpolysulfate (GAGPS) in experimental arthrosis of the knee in dogs (author’s transl). Z Orthop Ihre Grenzgeb 114:108, 1976. - PubMed -
118. Vanharanta H. Glycosaminoglycan polysulphate treatment in experimental osteoarthritis in rabbits. Scand J Rheumatol 12:225, 1983. - PubMed -
119. Burkhardt D, Ghosh P. Labratory evaluation of glycosaminoglycan polysulphate ester for chondroprotective activity: A review. Curr Ther Res 40:1034, 1986.
120. Hamm D, Goldman L, Jones E. Polysulfated glycosaminoglycan: A new intra-articular treatment for equine lameness. Vet Med 79:811, 1984.
121. Glade MJ. Polysulfated glycosaminoglycan accelerates net synthesis of collagen and glycosaminoglycans by arthritic equine cartilage tissues and chondrocytes. Am J Vet Res 51:779, 1990. - PubMed -
122. Halverson PB, Cheung HS, Struve J, et al. Suppression of active collagenase from calcified lapine synovium by arteparon. J Rheumatol 14:1013, 1987. - PubMed -
123. Steinmeyer J, Burton-Wurster N, Lust G. Effects of three antiarthritic drugs on fibronectin and keratan sulfate synthesis by cultured canine articular cartilage chondrocytes. Am J Vet Res 53:2077, 1992. - PubMed -
124. Sevalla K, Todhunter RJ, Vernier-Singer M, et al. Effect of polysulfated glycosaminoglycan on DNA content and proteoglycan metabolism in normal and osteoarthritic canine articular cartilage explants. Vet Surg 29:407, 2000. - PubMed -
125. Muller W, Panse P, Brand S, et al. In vivo study of the distribution, affinity for cartilage and metabolism of glycosaminoglycan polysulphate (GAGPS, arteparon). Z Rheumatol 42:355, 1983. - PubMed -




