CARLOS C. HODGES, dvm, ms, THERESA W. FOSSUM, dvm, ms, PhD, Diplomats acvs, and WINSTON EVERING, dvm, PhD
Техасский Университет A&M, кафедра ветеринарии мелких животных и хирургии (Hodges, Fossum), и кафедра патологической биологии (Evering), ветеринарный колледж, Колледж-Стейшин, Техас.
Заживление грудного протока (ГП) у шести здоровых собак оценивалось клинически и гистологичеки. У трех собак был сделан продольный разрез длиной 2,5 см, а у трех оставшихся собак ГП был полностью пересечен. Место дефекта помечали с помощью стального шовного материала 4-0 в ткани рядом с дефектом ГП. У всех собак образовался хилезный выпот, подтвержденный биохимическим анализом. К пятому дню после операции у собак с разрезом ГП и к 10 дню у собак с пересечением ГП накопление выпота прекратилось. Лимфангиография, проведенная через 7 дней после исчезновения выпота в грудной полости, показала проходимость ГП только у собак с разрезом, в отличие от собак с пересеченным ГП, он не выглядел проходимым. Гистологически у собак с разрезом ГП в месте операции был обнаружен один расширенный лимфатический сосуд (у одной собаки), при этом грудной проток и другие лимфатические сосуды у двух оставшихся собак выглядели нормальными. У одного животного обнаружено минимальное скопление нейтрофилов, макрофагов и лимфоцитов вокруг двух лимфатических сосудов. В соседних подплевральных участках обнаружено небольшое увеличения количества фиброзной соединительной ткани и образование новых сосудов. У собак с полным пересечением в месте пересечения присутствовало от трех до шести расширенных лимфатических сосудов. В грудном протоке одного животного отмечено легкое утолщение медии с "J"- образной зоной уплотненного коллагена, что предположительно представляло собой спавшийся грудной проток. В окружающей ткани присутствовали скопления макрофагов и лимфоцитов от легкой до умеренной степени, а также умеренное формирование новых сосудов, отделявших ее от нижележащей соединительной ткани. Заживший ГП гистологически не отличался от нормального.
Причины хилезного выпота в грудной полости у собак и кошек рассматриваются в литературе.1-4 У большинства животных причину, лежащую в основе, выяснить не удается, таким образом, хилоторакс классифицируют как идиопатический. У собак описаны случаи травматического разрыва грудного протока (ГП), однако это редко подтверждалось документально.2-3,5,6 У многих таких животных диагноз травматического хилоторакса ставился на основании недавней травмы в анамнезе или эпизодов бурной рвоты; разрыв протока не подтверждался при хирургической операции или лимфангиографии.7-11 Действительно, в нескольких случаях, когда предполагался травматический хилоторакс, подтвердить разрыв ГП с помощью лимфангиографии не удалось.2-4 Мы смогли найти только два опубликованных случаях травматического хилоторакса у животных, в которых дефект ГП был виден во время операции.5,6 У людей описаны случаи разрыва ГП после ряда чрескожных и хирургических вмешательств, травм, слишком бурного кашля или рвоты, а также переломов-вывихов позвонков.12-14
Возможно, что кажущаяся редкость травматического хилоторакса у собак и кошек является следствием быстрого заживления травм ГП, то есть, повреждение ГП заживает прежде, чем владелец сможет заметить симптомы нарушения дыхания и одышки, или во время медикаментозного лечения перед хирургическим вмешательством.
Это исследование проведено с целью оценки заживления лимфатической системы у собак после разреза и пересечения грудного протока в каудальной части.
Материалы и методы
Исследование проводилось на шести здоровых собаках-метисов весом от 15 до 25 кг. Клинический осмотр, полный клинический анализ крови, биохимический анализ крови и обзорные рентгеновские снимки грудной клетки не выявили нарушений. Перед включением в исследование всех собак вакцинировали и дегельминтизировали. Собак кормили раз в сутки (Hills Science Diet; поддерживающий корм) и давали воду неограниченно. За 12 ч до хирургического вмешательства корм убирали.
Собак случайным образом разделили на две группы. Перед хирургическим вмешательством делали премедикацию ацепромазина малеатом* (1 мг, внутримышечно [в/м]) и атропином† (0,1 мг/кг, ½ подкожно и ½ в/в). Для индукции наркоза использовали тиопентал‡ (10 мг/кг в/в), а для поддержания – 2% галотан § в кислороде. После подготовки к асептической операции всех собак укладывали на левый бок и делали брюшной доступ через межреберье с правой стороны. В брыжеечный лимфатический сосуд вводили тефлоновый катетер 22 G|| и закрепляли шелковым шовным материалом 3-0¶. К катетеру подсоединяли удлинительную инфузионную систему и закрепляли сходным образом, лимфангиографию проводили как описано ранее4 с помощью контрастного вещества # (1 мг/кг)** (рис. 1).
После лимфангиографии проводили торакотомию в правом девятом межреберье и находили ГП. Через катетер, установленный в брыжеечный лимфатический сосуд, вводили метиленовый синий для улучшения видимости ГП. Трем собакам формировали продольный разрез ГП длиной 2,5 см с помощью лезвия скальпеля №11. Оставшимся трем собакам ГП полностью пересекали лезвием скальпеля №11 без его выделения. Если ГП имел несколько ветвей, надрезали или пересекали основную ветвь. У всех собак был виден хилус, вытекающий из дефекта ГП. Место каждого дефекта помечали шовным материалом из нержавеющей стали 4-0, накладывая его на соседнюю ткань. После формирования всех дефектов ГП лимфангиографию повторяли, чтобы подтвердить вытекание из места разреза или полного пересечения (рис. 2). Устанавливали торакостомическую трубку, делали блокаду межреберного нерва, извлекали катетеры из брыжеечного лимфатического сосуда и ушивали оба разреза обычным способом. Вводили обезболивающие препараты (буторфано놆 0,22 мг/кг, часть подкожно и часть внутривенно) по необходимости для обезболивания после операции.
Ежедневное наблюдение состояло из контроля температуры, пульса и дыхания, аспирации жидкости через торакостомическую трубку и записи объема полученной жидкости. Для всех собак использовали фиксирующие устройства из металлических стержней, чтобы не допустить смещения торакостомических трубок и самотравмирования на протяжении исследования. В первый день после операции хилоторакс был подтвержден биохимическим анализом сыворотки и плевральной жидкости на содержание холестерина и триглицеридов, а также цитологическим исследованием жидкости из грудной полости. Хилоторакс считался подтвержденным, если концентрация триглицеридов в плевральной жидкости в 2-3 раза превышала концентрацию триглицеридов в сыворотке. После уменьшения объема выпота в грудной полости до менее 2 мл/кг в сутки, или в случае отсутствии жидкости при аспирации в течение 2 дней торакостомические трубки удаляли. Лимфангиографию повторяли с применением того же протокола, как описано ранее для второй процедуры наркоза, через 7 дней после исчезновения выпота в грудной полости. Через 2 недели после лимфангиографии собаки подверглись эутаназии путем внутривенной болюсной инъекци膆 и вскрытию. Место дефекта ГП находили по стальному шовному материалу и отбирали пробы тканей для гистологического исследования. Ткани фиксировали 10% забуференным раствором формалина, изготовляли срезы толщиной 5-6 мм и окрашивали гематоксилином и эозином. Дополнительные срезы каждой ткани окрашивали красителями Ван Гизона, трехцветным - Масона и по Уилдеру и Гомори.
- *Ацепромазин, Fort Dodge Laboratories, ФортДодж, Айова.
- † Атропин. Vedco. Inc.. Сан-Джозеф, Миссури.
- ‡Био-тал. Bio-Ceutic Division. Сан-Джозеф, Миссури.
- § Флуотан, Fort Dodge Laboratories, Inc., ФортДодж, Айова.
- || Becton. Dickinson and Co., Рутерфорд, Нью-Джерси.
- ¶ Deknatel, Inc., ФоллРивер, Массачуссетс.
- # Ренограффин—76, Squibb Diagnostics, Нью-Брансвик, Нью-Джерси.
- **Результаты лимфангиографии у этих собак публиковались ранее: Hodgesetal. Lymphoscintigraphy in healthy dogs and dogs with experimentally created thoracic duct abnormalities. Am J Vet Res 1992;53:1048-1053.
- †† Буторфанолатартрат, Fort Dodge Laboratories, ФортДодж, Айова.
- ††SleepAway, Fort Dodge Controlled Substances Center, ФортДодж, Айова.
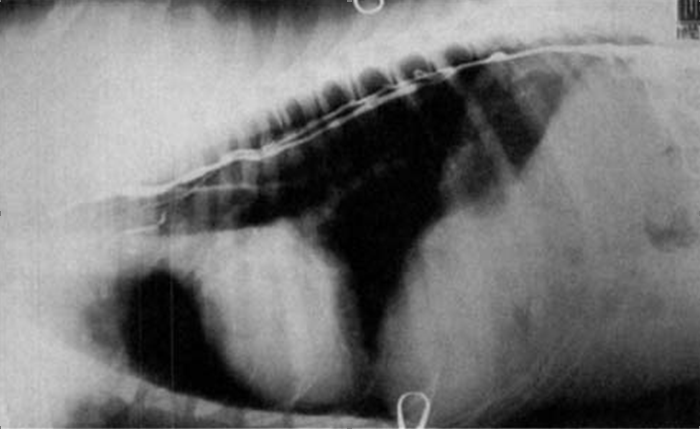
Рис. 1.
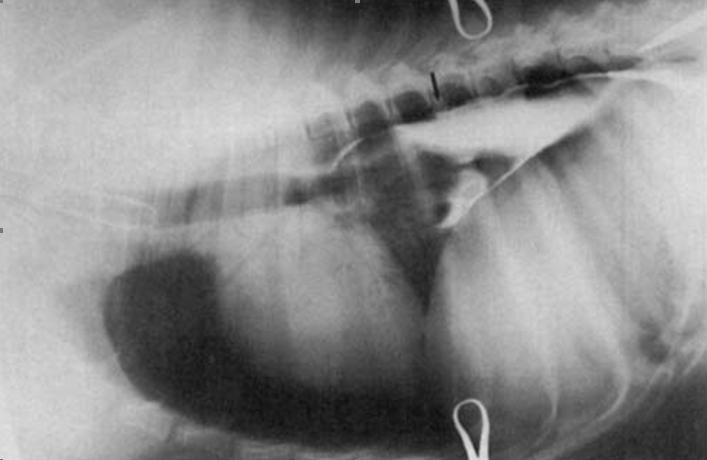
Рис. 2. Рентгеновский снимок грудной клетки собаки с продольным разрезом ГП длиной 2,5 см после введения контрастного вещества в брыжеечный лимфатический узел, в левой боковой проекции. Обратите внимание на вытекание контрастного материала из ГП в месте разреза (стрелка).
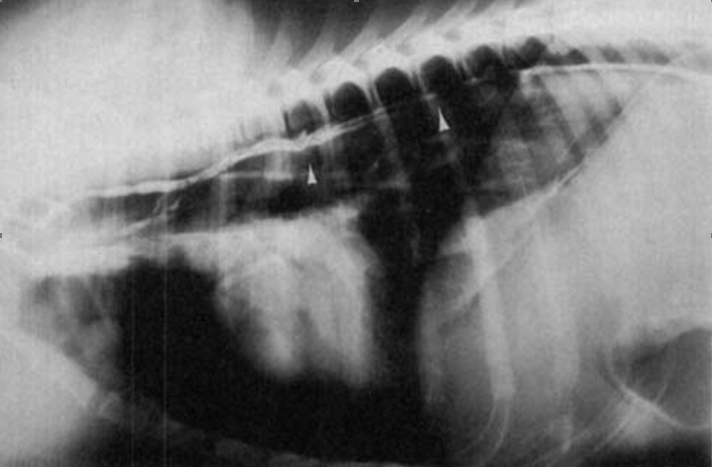
Рис. 3. Та же собака, что на рис. 1, с продольным разрезом длиной 2,5 см после введения контрастного вещества в брыжеечный лимфатический сосуд через 7 дней после исчезновения выпота в грудной полости; снимок показывает проходимость ГП (между стрелками).
Результаты
Трем из шести собак требовались обезболивающие средства непосредственно после операции. Повышения температуры тела не отмечено ни у одной из собак на протяжении исследования. Все собаки получали полноценный рацион в первый день после операции и хорошо переносили торакостомические трубки на протяжении всего исследования.
Хилоторакс, индуцированный хирургически, был подтвержден у всех собак. Концентрация триглицеридов в сыворотке составила 33-65 мг/дл, а в плевральной жидкости – 120-573 мг/дл. У собак с разрезом ГП объем жидкости в грудной полости, отбираемый ежедневно, составил от 7 до 65 мл, и скопление выпота прекратилось (т. е. торакостомические трубки были удалены) через 2-5 дней после операции. У собак с пересечением ГП объем удаляемой ежедневно жидкости составил от 10 до 90 мл, и выпот перестал накапливаться через 4-10 дней после операции.
Лимфангиография, повторенная через 7 дней после исчезновения выпота в грудной полости, показала проходимость ГП у всех собак в группе с разрезом (рис. 3). В группе, где ГП пересекали, он был непроходим у всех собак. У этих собак было видно контрастное вещество в каудальной части ГП, однако краниальнее места полного пересечения контрастирование ГП отсутствовало (рис. 4). У всех собак в обеих группах были обнаружены множественные ветви ГП.
При вскрытии у всех собак обнаружен плевральный выпот (примерно 10-20 мл серозно-кровянистой жидкости) и множественные спайки в грудной полости. У некоторых собак каудальная доля правого легкого и перикард были спаяны с диафрагмой. Плевра средней доли правого легкого у некоторых собак была спаяна с реберной плеврой. Поверхность плевры над местом разреза ГП была твердой, присутствовали фиброзные спайки. У собак с полным пересечением были обнаружены расширенные лимфатические сосуды каудальнее исходного дефекта.
При гистологическом исследовании после разреза ГП был обнаружен только один умеренно расширенный лимфатический сосуд у одной собаки, в то время как у оставшихся двух собак грудной проток и другие лимфатические протоки выглядели нормальными. Под плеврой соседних участков у всех животных отмечено легкое увеличение количества фиброзной соединительной ткани, образование новых сосудов и легкое скопление макрофагов и лимфоцитов. У двух животных на плевральных поверхностях отмечены отдельные «язычки» фибрина, захватывающие небольшое число нейтрофилов. У одного животного отмечено минимальное околососудистое скопление нейтрофилов, макрофагов и лимфоцитов вокруг двух ГП. У трех собак с полным пересечением в месте пересечения было обнаружено от трех до шести умеренно расширенных лимфатических сосудов. У одного животного было заметно легкое утолщение медии ГП. Рядом с этим лимфатическим сосудом отмечена "J"- образная область уплотненного коллагена с остатками эндотелия в центре, что соответствовало спавшемуся грудному протоку. У двух животных в тканях, окружающих место операции, обнаружено скопление макрофагов, лимфоцитов и нейтрофилов от легкой до умеренной степени, а также умеренное образование новых сосудов в участках, соседствующих с мезотелием, что отделяло эти ткани от подлежащей соединительной ткани. Кроме того, над обширными ограниченными участками стенок грудного протока была обнаружена более зрелая грануляционная ткань, нарушающая структуру эластичных слоев плевры. У третьего животного в месте хирургического вмешательства присутствовали разветвленные структуры с сосочками, выстланные мезотелиальными клетками. В большинстве случаев на плевральной поверхности над этими зонами присутствовали реактивные мезотелиальные клетки, не связанные с грануляционной тканью.
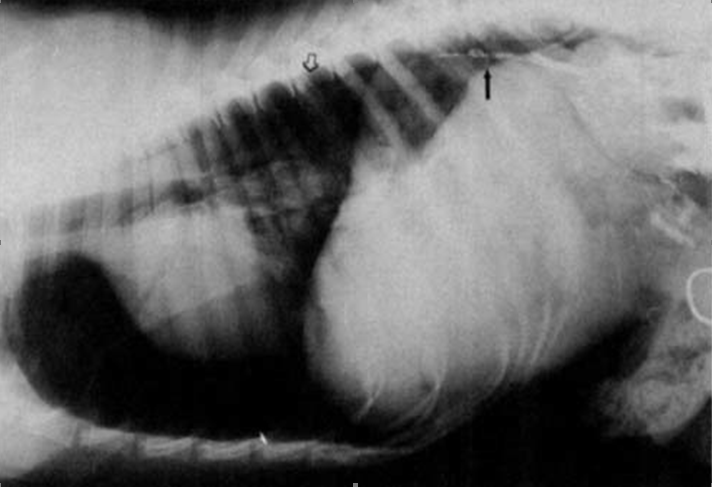
Рис. 4. Рентгеновский снимок в левой боковой проекции у собаки с полным пересечением ГП после инъекции контрастного вещества в брыжеечный лимфатический узел через 7 дней после исчезновения выпота в грудной полости; контрастное вещество видно только в каудальной части пересеченной ветви ГП (стрелка). Контрастное вещество присутствует на уровне стального шовного материала (место пересечения – контурная стрелка).
Обсуждение
Заживление ГП у собак после экспериментального разреза происходило быстро, что подтверждает клинические рекомендации по нехирургическому лечению травматического хилотракса.1 Результаты этого исследования дают основания полагать, что ГП здоровых собак заживает в течение 2 недель после разреза и полного пересечения. Кроме того, это исследование показывает, что шансы на подтверждение дефекта ГП у собак с предполагаемым травматическим хилотораксом могут быть низкими, если исследование проводится позднее 7 суток после травмы. Обычно лимфангиография проводится только животным с идиопатическим хилотораксом (не отвечающим на хирургическое лечение), при этом обычно обнаруживается расширение грудных лимфатических сосудов.
В группе с разрезом ГП подтекание содержимого прекратилось в течение 5 суток, а в группе с пересечением – в течение 10 суток. Причина различия между двумя группами неизвестна, однако возможно, связана с типом созданного дефекта. У собак с несколькими ветвями ГП ток лимфы мог быть перенаправлен по неповрежденным ветвям, что ускорило заживление.
Объем аспирированной жидкости в обеих группах был меньше, чем обычно наблюдается у собак с идиопатическим хилотораксом и расширением грудных лимфатических сосудов. Сообщалось, что нормальный ток лимфы в ГП собак составляет примерно 0,04 мл/мин. или примерно 58 мл/кг в сутки.15-17 Таким образом, можно было ожидать, что образование хилуса у собак в этом исследовании составит 870-1450 мл в сутки. У животных с расширением грудных лимфатических сосудов присутствуют многочисленные расширенные сосуды, через которые хилус может просачиваться в грудную полость.2,3 Повышенные объемы хилезного выпота у животных с идиопатическим хилотораксом и расширением лимфатических сосудов можно приписать повышенному венозному давлению, приводящему к усилению тока в ГП.3 У здоровых животных в этом исследовании меньший объем хилуса, протекающий через ГП, мог быть причиной снижения объема, попадающего в грудную полость. Кроме того, меньший объем жидкости, полученной при торакоцентезе у этих животных, мог объясняться всасыванием жидкости лимфатическими сосудами в плевральном пространстве и диафрагме. У собак со спонтанным хилотораксом и предположительно нарушенным оттоком лимфы реабсорбция из плеврального пространства может быть снижена.
Повторная лимфангиография показала проходимость грудного протока у собак с его разрезом. Форма и размер ГП до и после формирования дефекта выглядели сходными; сжатия или сужения ГП не отмечено.
Гистологческое исследование показало, что участки заживления состояли из зрелой фиброзной ткани, мононуклеарной и лимфоцитарной инфильтрации и новообразованных сосудов. Эти результаты значительно не отличались от наблюдаемых при заживлении любого лимфатического сосуда после травмы.18 Расширенные лимфатические сосуды, обнаруженные у животных с пересеченным ГП, могли представлять собой активированные коллатеральные сосуды или анастомозы, а не зажившие пересеченные сосуды. Отсутствие восстановления стенки лимфатических сосудов говорит в пользу этого предположения, а обнаружение спавшегося ГП может указывать на резервные возможности, в конечном итоге приводящие к образованию коллатералей при пересечении лимфатических сосудов. В пользу этого сценария говорят результаты лимфангиографии, сделанные через несколько дней после пересечения, когда ГП не выглядел проходимым. И наоборот, расширение лимфатических сосудов у собак с продольным разрезом ГП было незначительным, что указывает на быстрое заживление дефекта.
Однако сделать окончательное заключение сложно, так как спавшиеся сосуды присутствовали не у всех собак, и восстановление могло происходить как в пересеченном, так и в продольно надрезанном ГП. Кроме того, грудной проток каудальнее сердца не является одиночной структурой и может иметь до 4 коллатеральных ветвей, возможно, с несколькими анастомозами между ними.519 Таким образом, дифференцировать сосуд, заживший с минимальной пролиферацией соединительной ткани, от существующих коллатералей сложно.
Это исследование дает основания полагать, что после разреза или пересечения ГП у собак возможно самопроизвольное заживление. Недостаток гистологических данных, показывающих очевидные признаки восстановления разорванного ГП вторичным натяжением, указывает, что заживление происходит с минимальной пролиферацией соединительной ткани. Для дальнейшего изучения процесса заживления дефектов ГП необходимы дополнительные исследования на более ранних стадиях, а также более длительное наблюдение.
Литература
- Birchard SJ. Smeak DD, Fossum TW. Results of thoracic duct ligation in dogs with chylothorax. J Am Vet Med Assoc 1988: 193:68-71.
- Fossum TW, Birchard SJ, Jacobs RM. Chylothorax in 34 dogs. J Am Vet Med Assoc 1986: 188: 13 15- I3 18.
- Fossum TW, Forrester SD, Swenson CL, et al. Chylothorax in cats:37 cases (1969-1989). J Am Vet Med Assoc 1991: 198:672-678.
- Birchard SJ, Cantwell HD. Bright RM. Lymphangiography and ligation of the canine thoracic duct: A study in normal dogs and three dogs with chylothorax. J Am Anim Hosp Assoc 1982; 18:769-777.
- Patterson DF, Munson TO. Traumatic chylothorax in small animals treated by ligation of the thoracic duct. J Am Vet Med Assoc 1958; 1:452-458.
- Bradley R, DeYoung DW. Chylothorax with concurrent chyloabdomen in a dog: A case report. Vet Med/Small Anim Clin 1977; June: 1024-1027.
- Black DJ. Iatrogenic chylothorax in a dog. J Am Vet Med Assoc 1977; 170:543-544.
- Stonesifer CA, Moffett WF. Successful treatment of chylothorax in a dog by thoracic duct ligation: a case report. J Am Anim Hosp Assos 1974; 10:486-487.
- Donahoe JM. Kneller SK, Thompson PE. Chylothorax subsequent to infection ofcats with Dirufrlaria irnrnitis. J Am Vet Med Assoc 1974:11:1107-1110.
- Graber ER. Diagnosis and treatment of a ruptured thoracic duct in the cat. J Am Vet Med Assoc 1965; 146:242-245.
- Meincke JE, Hobbie WV, Barto LR. Traumatic chylothorax with associated diaphragmatic hernias in the cat. J Am Vet Med Assoc 1969; 155:15-20.
- Williams KR. Burford TH. The management of chylothorax related to trauma. J Trauma 1963; 3:317-325.
- Pai GP, Bhatti NA. Ellison RG, et al. Thoracic duct injury from blunt trauma. South Med J 1984;77:667-668.
- Sachs PB, Zelch MG, Rice TW, et al. Diagnosis and localization of laceration of the thoracic duct: usefulness of lymphangiography and CT. Am J Roentgenol 1991; 157:703-705.
- Haider M, Schad H, Mendler N. Thoracic duct lymph and PEEP studies in anaesthetized dogs: 11. Effect of a thoracic duct fistula on the development of a hyponcotic-hydrostatic pulmonary oedema. Intensive Care Med 1987; 13:278-283.
- Browse NL, Rutt DR, Sizeland D, et al. The velocity of lymph flow in the canine thoracic duct. Am J Physiol 1971;237:401-413.
- Schad H, Brechtelsbauer H. Thoracic duct lymph flow and composition in conscious dogs and the influence of anaesthesia and passive limb movement. Pflugen Arch 1977;371:25-31.
- Jones TC, Hunt RD. Veterinary Patholugy 5th ed. Philadelphia: Lea & Febiger, 1983:1290.
- Skelley JF, Prier JE, Kochler R. Applications of direct lymphangiography in the dog. Am J Vet Res 1964;25:747-755.




