Интенсивная терапия тяжелой черепно-мозговой травмы (ТЧМТ) относится к наиболее сложному разделу реаниматологии. Уникальные структурно-функциональные особенности головного мозга, играющие ведущую роль в интеграции организма в единое целое, а также особенности метаболизма – строго ограниченные метаболические запросы и малые запасы субстратов энергетического обеспечения предопределяют особенности патологического процесса и стратегию лечения ТЧМТ.
Несмотря на достигнутые успехи в изучении патофизиологических механизмов, развивающихся при травматическом поражении структур головного мозга, интимные механизмы, приводящие к гибели нейронов, а также методы активного воздействия и динамического контроля за терапией во многом остаются нерешенными.
В настоящее время большинство исследователей, занимающихся лечением повреждений головного мозга, едины в том, что основой успешной терапии тяжелой черепно-мозговой травмы является обеспечение мозгового кровотока, адекватного метаболическим запросам мозга. Оптимизация церебральной перфузии и кислородного транспорта является важнейшей задачей интенсивной терапии нейротравмы.
Патофизиология нейротравмы
Современные представления о травматической болезни головного мозга описываются двуфазным (стадийным) течением патологического процесса.
Начальный период (острейшая фаза) характеризуется действием непосредственно повреждающего фактора на нервную ткань с быстрым формированием очага поражения, или травматического субстрата. Длится эта фаза (в зависимости от характера поражающего фактора) от нескольких минут до 6 часов. И хотя данный период рассматривают в качестве «терапевтического окна надежды», его жесткие временные рамки существенно ограничивают возможности лечебных мероприятий. В этот период необходимо по возможности минимизировать очаг повреждения, что наиболее актуально при нарастающей гематоме.
В дальнейшем развивается следующая фаза, в которой к действию повреждающего фактора присоединяется нарастающее воздействие самого очага поражения и продуктов распада на окружающие ткани и мозг в целом, что в итоге, как правило, и определяет длительность, исход заболевания и особенности восстановительного периода.
В зависимости от вида механической энергии, ее кинетики, направленности и места приложения возникают следующие формы первичного поражения мозга: очаговые ушибы и размозжения, диффузные аксональные повреждения, первичные внутричерепные кровоизлияния, разрывы ствола, сдавление головного мозга вдавленными переломами костей черепа и сдавление головы. Первичные структурные повреждения головного мозга являются пусковым механизмом, запускающим вторичные интра- и экстракраниальные механизмы поражения головного мозга. К вторичным интракраниальным поражениям относят сдавление головного мозга внутричерепными гематомами, отек/набухание мозга, гемо- и ликвороциркуляции, гидроцефалию. К вторичным экстракраниальным поражениям относят гипоксемию, артериальную гипо- и гипертензию, нарушения в иммунной системе, в системе регуляции агрегатного состояния крови, в обмене электролитов.
В ближайшем посттравматическом периоде происходит высвобождение большого количества возбуждающих нейромедиаторов, что приводит к интенсификации потребления мозгом кислорода. Рост метаболизма в наибольшей степени отмечается в клетках, прилегающих к зоне повреждения, в так называемой «зоне полутени» (в англоязычной литературе penumbra – полутень). Если мозговой кроток не увеличивается или увеличивается недостаточно, то, как следствие, транспорт кислорода к мозгу будет также недостаточным, что обуславливает нарушения энергообеспечения нейроцитов и развития дефицита их функции. С практической точки зрения наиболее важными являются первые 3–5 суток заболевания, в течение которых сохраняется возможность активного медикаментозного влияния на ход обменных процессов и поддержания жизнеспособности нервных клеток и глий в очаге поражения и окружающих тканях.
Ведущим патогенетическим фактором в зоне поражения нервной ткани является гипоксия. В соответствии с современными представлениями, гипоксия – это патофизиологический процесс, развивающийся в условиях дефицита кислорода или действия токсических веществ, в основе которого лежит инактивация митохондриальных ферментных и ионотранспортных комплексов, что приводит к нарушению аэробного синтеза энергии, торможению (или полной блокаде) энергозависимых метаболических функций клеточных мембран, к структурным изменениям и гибели нервных клеток (Лукьянова Л. Д., 1999). Патологические эффекты гипоксии реализуются двумя путями: вследствие прямого воздействия на биоэнергетический аппарат клетки с нарушением его функций (биоэнергетическая гипоксия) и опосредованно, через стрессорную активацию нейрогуморального звена, приводящего к запуску реакций «патологического» метаболического каскада; формирование условий, ухудшающих диссоциацию оксигемоглобина и ограничивающих поступление кислорода в клетки с развитием «метаболической гипоксии». Последняя, в свою очередь, «подпитывает» биоэнергетическую гипоксию. Прогрессирующий энергетический дефицит активирует генетически запрограммированный процесс гибели клеток – апоптоз, что также вызывает отсроченную гибель нейронов.
Классификация ЧМТ (черепно-мозговой травмы)
По особенностям внешнего воздействия выделяют группу действий предмета на ограниченный участок головы, сдавление головы, удары головой о неподвижные предметы. Особую группу составляют огнестрельные повреждения головы и головного мозга.
По типу травмирующего воздействия черепно-мозговая травма может быть изолированной, сочетанной (повреждающее воздействие механической природы на другие органы и системы, кроме головы), комбинированной (совокупное воздействие механической и других видов энергии – термической, химической, радиационной и др.).
По характеру повреждения черепно-мозговые травмы подразделяют на закрытые и открытые. К закрытым черепно-мозговым травмам относят повреждения головного мозга с наличием или отсутствием повреждений кожных покровов головы, но без повреждения апоневроза, с переломами костей черепа и без таковых, но с обязательным отсутствием сообщения полости черепа с внешней средой.
К открытым черепно-мозговым травмам относят случаи с повреждением апоневроза или наличием сообщения полости черепа с внешней средой.
В рамках открытой черепно- мозговой травмы выделяют непроникающую (без повреждения твердой мозговой оболочки) и проникающую (с повреждением твердой мозговой оболочки) .
По виду повреждения мозговой ткани различают диффузные (сотрясение мозга, диффузные аксональные повреждения), очаговые (ушибы, размозжение, кровоизлияние, сдавлениe) и сочетанные повреждения.
По тяжести ЧМТ выделяют следующие степени:
- легкая (сотрясение головного мозга, ушибы мозга легкой степени),
- средняя (ушибы мозга средней степени тяжести),
- тяжелая (ушибы мозга тяжелой степени, острые сдавления мозга, диффузные аксональные повреждения и сдавление головы).
В течении ЧМТ различают три базисных периода (Лихтерман Л. Б., 1994):
- острый период, в основе которого лежат процессы взаимодействия травмированного субстрата, реакций повреждения и защиты. Примерные сроки:
- при сотрясении головного мозга – до 1–2 недель;
- при ушибе легкой степени – до 2–3 недель;
- при среднетяжелом ушибе – до 4–5 недель;
- при тяжелом ушибе – до 6–8 недель;
- при сдавлении головного мозга – от 3 до 10 недель (в зависимости от фона);
- промежуточный период, в основе которого лежат рассасывание и организация участков повреждения и развитие компенсаторно-приспособительных процессов в ЦНС. Продолжительность его составляет:
- при легкой ЧМТ – до 1 месяца;
- при среднетяжелой – до 4 месяцев;
- при тяжелой – до 6 месяцев;
- отдаленный период, в его основе лежит завершение процессов или сосуществование местных и дистантных деструктивно-регенераторных процессов; при благоприятном течении – полное или почти полное клиническое уравновешивание патологических сдвигов, при неблагоприятном течении – рубцовые, атрофические, спаечные, вегетовисцеральные, аутоиммунные процессы. Продолжительность периода при благоприятном течении – до 2 лет, при прогредиентном – не ограничена.
По исходам ЧМТ выделяют хорошее восстановление функций (выздоровление), умеренное, грубые нарушения, вегетативный статус и смерть. Клинические формы ЧМТ базируются на виде, тяжести и морфологическом субстрате поражения мозга. Выделяют следующие клинические формы ЧМТ: сотрясение головного мозга, ушибы мозга различной степени тяжести (легкие, средние, тяжелые), сдавление мозга (гематомы, вдавленные переломы, напряженная пневмоцефалия), диффузные аксональные повреждения мозга и сдавление головы.
Клинические формы ЧМТ
Сотрясение головного мозга – наименее тяжелое функциональное поражение головного мозга, не сопровождающееся явными макроскопическими повреждениями нервной ткани. Характеризуется четкими неврологическими нарушениями, синдромом легкой формы диффузного поражения мозга. Морфологическим субстратом его является повреждение синаптического аппарата коры полушарий мозга и диэнцефальной области. Происходит набухание отростков астроцитов, уплотнение митохондрий, расширение межклеточных пространств с переходом воды из клеток в интерстиций. Период активации через два часа сменяется его истощением, набуханием глиальных клеток, митохондрий, микровакуолизацией дендритов, гиперхромией нейронов. Через сутки структурно-функциональные изменения, кроме коры и диэнцефальной области, захватывают ствол, в котором они сохраняются значительно дольше, чем в корковых структурах.
Клинически характеризуется появлением следующих синдромокомплексов: вестибулярно-стволовой (нистагм, тремор, шаткость), вегетососудистый (артериальная гипертензия, тахи- или брадикардия, тахипноэ, гипертермия), психоневрологический (возбуждение или сонливость, кратковременные очаговые неврологические нарушения), нарушение реакции на внешние раздражители. Субарахноидальное кровоизлияние отсутствует.
Ушибы мозга (первичные травматические некрозы) возникают в момент травмы на месте удара или противоудара. Представляют собой очаги геморрагического размягчения мозговой ткани, в которых выделяют зону разрушения, зону необратимых изменений и зону обратимых изменений. В зоне необратимых изменений кровоток падает до уровня ишемии сразу после травмы; в зоне обратимых изменений он вначале усиливается, далее в течение трех часов постепенно падает до уровня ишемии, что ведет к развитию вторичных некрозов и увеличению размеров очага ушиба. Выделяют понятие агрессивного ушиба головного мозга. Под этим термином подразумевают склонность очага ушиба к увеличению паранекротической зоны на 2–4-е сутки после травмы. Это связано с формированием отека в данной зоне с целью санации от образованных антигенов. В случае неконтролируемости этого локального отека мозга очаг некроза увеличивается.
Выделяют три степени ушиба головного мозга:
- Ушиб головного мозга легкой степени гистологически характеризуется точечными кровоизлияниями в коре мозга с ограниченным субарахноидальным кровоизлиянием. Могут наблюдаться переломы черепа. Организация ушиба заканчивается глиозом. Нарушение витальных функций отсутствует, возможно развитие умеренной бради- или тахикардии, артериальной гипертензии. Неврологическая симптоматика: легкая анизокория, клонический нистагм, пирамидные и менингеальные симптомы. Регресс симптоматики наступает на 2–3-й неделе посттравматического периода.
- Ушибы головного мозга средней степени тяжести – очаги первичного некроза захватывают кору и прилежащее белое вещество. Характерна клиновидная форма контузионного очага с пропитыванием его кровью через 8–10 часов. Через неделю в зону активно врастают новообразованные сосуды, а через 3–4 месяца зона замещается глиальным или глиомезодермальным рубцом. Могут быть переломы черепа, обязательно умеренное субарахноидальное кровоизлияние. Клинически характеризуется отсутствием реакции на внешние раздражители после травмы. Возможны преходящие нарушения витальных функций: бради- или тахиаритмия, артериальная гипертензия. Наблюдаются менингеальные симптомы, нистагм, нарушение мышечного тонуса и сухожильных рефлексов симметрично или асимметрично, появление патологических рефлексов. Четко проявляется очаговая симптоматика ушиба того или иного участка головного мозга. Отмечается ликворная гипертензия. Регресс симптоматики продолжается до 3–5-й недели после ЧМТ.
- Ушибы головного мозга тяжелой степени тяжести характеризуются разрушением мягкой мозговой оболочки, захватывают кору и белое вещество, доходя до подкорковых ганглиев, субарахноидальное кровоизлияние тяжелой степени. Отмечаются не только местные, но общие нарушения мозгового кровообращения с развитием тромбозов, стаза и кровоизлияний. Организация зон некроза идет по пути формирования поликистозных глиальных или глиомезодермальных рубцов. Клинически характеризуется отсутствием реакции на внешние раздражители: животное на кличку не отзывается, хозяев не узнает. Сопровождается расстройством витальных функций: бради- или тахиаритмиями, артериальной гипертензией, тахи- и брадипноэ с нарушением ритма дыхания и бронхиальной проходимости. Выражены гипертермия или гипотермия, иногда двигательное возбуждение. В ряде случаев доминирует первичная стволовая симптоматика: симптом Мажанди (форма приобретенного косоглазия, при которой на стороне поражения глазное яблоко повернуто книзу и внутрь, а на противоположной – кверху и наружу. Возникает при поражении медиального продольного пучка в стволе мозга. Часто носит прогностически неблагоприятный характер), плавающие глазные яблоки, нарушения взора, нистагм, миоз или мидриаз, бульбарный синдром. Асимметричное нарушение глазодвигательных функций при бессознательных состояниях чаще сопутствует структурным поражениям мозга, чем нарушениям его метаболизма. В первые часы после травмы первичная стволовая симптоматика скрывает очаговые симптомы поражения. Возможны судорожные приступы. Отмечается ликворная гипертензия. Как правило, имеются переломы костей черепа.
Выделяют три основных варианта проявления ушиба головного мозга тяжелой степени:
- с первичными полушарными симптомами выпадения, без нарушения витальных функций;
- с первичными проявлениями стволовых нарушений, преимущественно среднего мозга, грубыми витальными нарушениями (средний мозг участвует в обеспечении вегетативно-висцеральных функций организма);
- с грубыми первичными симптомами стволового поражения, преимущественно дистальных его отделов, и грубыми витальными нарушениями.
По типу течения заболевания выделяют три варианта: регрессирующий, ремиттирующий и прогрессирующий. Сдавление головного мозга в основном обусловлено наличием внутричерепной гематомы. Характеризуется нарастающими после травмы общемозговыми, очаговыми и стволовыми нарушениями, которые появляются через различные временные промежутки. Выделяют острое сдавление (клинические проявления в первые трое суток после травмы), подострое сдавление (клинические проявления возникают на 2–7-е сутки) и хроническое сдавление (клинические проявления возникают через неделю).
Клиническая картина острого сдавления головного мозга обычно является результатом формирования массивных гематом вследствие артериального кровотечения в сочетании с ушибом головного мозга или результатом внедрения в полость черепа отломков костей при вдавленных переломах. Клинические формы подострого и хронического сдавления головного мозга развиваются при медленном формировании очага компрессии, при наличии резервных пространств в полости черепа, при замедленной реакции мозговой ткани на травму, при отсутствии значительных очагов ушибов мозга.
В клинике сдавления головного мозга различают светлый промежуток между первичной общемозговой и очаговой симптоматикой и симптомами, нарастающими в процессе роста гематомы. При большом объеме гематомы светлый промежуток может отсутствовать.
Клинически, помимо анизокории и пирамидных симптомов, отмечаются менингеальный симптомокомплекс, в ряде случаев ипсилатеральный гемипарез, обусловленный сдавлением контрлатеральной ножки мозга.
Внутримозговые гематомы: тип течения заболевания либо острый, либо подострый. При остром типе преобладают симптомы поражения ствола и гипертензионно-дислокационный синдром.
Дислокационный синдром – смещение полушарий головного мозга или полушарий мозжечка в горизонтальном или аксиальном направлении, вызывающее комплекс клинических и морфологических проявлений вследствие сдавления стволовых структур мозга с вторичным нарушением как общего, так и локального крово- и ликворообращения. Дислокационный синдром (ДС) развивается вследствие изменения внутричерепных объемных процессов. В неотложной нейрохирургии при внутричерепных травматических и нетравматических гематомах, кровоизлияниях в опухоли мозга, ушибах и размозжениях мозга, острой окклюзионной гидроцефалии, регионарном и генерализованном отеке мозга, оружейных ранениях и пр. прогноз для жизни зависит от глубины и длительности поражения структур мозга, регулирующих жизненно важные функции организма (кровообращения, дыхания). В связи с этим установление дислокации, ее диагностика, определение степени обусловленных ею витальных нарушений является первоочередной задачей неотложной нейрохирургии и нейрореанимации. Наличие или отсутствие дислокации, вероятность ее возникновения часто является показанием к срочному хирургическому вмешательству и определяет объем вмешательства.
Величина поперечного смещения мозга при хронических и острых объемных процессах может достигать 5–15 мм и более (по данным КТ и МРТ). Аксиальное же смещение при острых внутричерепных процессах никогда не бывает значительным, миндалики мозжечка лишь "вдавливаются" в затылочно-шейную воронку и не опускаются в нее, как это бывает при хронической дислокации, когда смещенные миндалины могут достигать уровня второго шейного позвонка. Клинически же острая аксиальная дислокация мозга протекает несравненно более бурно и тяжело, чем поперечная, а тем более хроническая. Объясняется это тем, что при хронических объемных процессах мозг успевает адаптироваться к новым условиям, включает защитные механизмы, тогда как при острой дислокации адаптационные механизмы защиты мозга раскрыться не успевают.
Развитие дислокационного синдрома обусловлено тем, что мозг находится в замкнутой полости и при увеличении объема самого мозга (отек), и при возникновении иных объемных интракраниальных образований (травматические и нетравматические гематомы, посттравматическая гемоангиопатическая ишемия и пр.) образующаяся масса не может выйти за пределы полости черепа. В нормальных условиях мозг, интерстициальная и цереброспинальная жидкости находятся под разным давлением в соотношении 2:0,1:1. При формировании же дополнительного внутричерепного объема это соотношение изменяется, и одни структуры могут находиться под повышенным, другие под пониженным, третьи под нормальным давлением. Развивается так называемая дистензия. Вследствие этой дистензии, разыгрывающейся в замкнутом пространстве, отдельные части мозга начинают смещаться в естественные отверстия и щели внутричерепной полости – под falx, в вырезку мозжечкового намета, в шейно-затылочную воронку. Сместившиеся сюда части мозга могут ущемляться, образуя ущемленные мозговые грыжи. Смещенные участки мозга оказывают давление на ствол мозга, смещая его, прижимая противоположный от вклинившейся части мозга край ствола к ригидному краю намета мозжечка, приводят к сдавлению нижних отделов ствола. Нарастающее внутричерепное давление может превысить артериальное давление крови, которое к этому моменту становится нестабильным, низким (90 мм. рт. ст. и ниже). Тогда общий мозговой кровоток замедляется или прекращается вовсе.
Подострый тип проявляется в виде умеренно выраженных гипертензионных проявлений и очаговых полушарных симптомов. Появляются на 5–10-й день после травмы и имеют четко прогредиентный характер (нарастают симптомы поражения мозга).
Напряженная пневмоцефалия всегда является признаком перелома коcтей черепа, повреждения твердой мозговой оболочки и скрытой или явной ликвореи. Поступление воздуха в полость черепа обусловлено снижением внутричерепного давления из-за ликвореи, но напряженная пневмоцефалия возникает только при наличии клапанного механизма. Это приводит к увеличению объема воздуха в полости черепа (в субдуральном пространстве, внутри желудочков мозга), повышению интракраниального давления и сдавлению структур мозга. Клиническая симптоматика выражена негрубо и складывается из гипертензионных проявлений, редко психомоторных нарушений (сдавление лобных долей) и очаговых неврологических знаков. Обычно имеет подострое течение. Ведущими являются признаки ушиба мозга и ликворея.
Классические признаки внутричерепной гематомы:
- наличие светлого промежутка (возможен в редуцированной форме);
- брадикардия;
- анизокория;
- контралатеральный гемипарез.
Диагностика ЧМТ
Диагностические процедуры и мониторинг у пациентов с нейротравмой имеют целью раннее определение степени первичных и вторичных органических поражений.
Клинико-неврологический метод остается основным и обязательным в диагностике ЧМТ и дополняется современными методами прижизненной визуализации мозговых структур и биоэлектрической активности головного мозга.
Клинико-неврологический метод основывается на знании клинических форм ЧМТ и характерной для них неврологической симптоматики. Для адекватной оценки клинической формы ЧМТ необходимо правильно классифицировать уровень нарушения активности головного мозга.
Выделяют 6 градаций состояния сознания:
- Норма – сохранены все психические функции, характерно бодрствование, полная ориентация, адекватная реакция на предъявленные раздражители.
- Оглушение – угнетение при сохранности ограниченного контакта на фоне повышенного порога восприятия внешних раздражителей и снижения собственной психической и двигательной активности.
- Умеренное оглушение – частичное угнетение, вследствие чего снижена способность к активному вниманию. Команды выполняются правильно, но с задержкой. Глаза открывает на кличку. Реакция конечностей на боль активная, целенаправленная. Повышенная истощаемость, вялость, сонливость. Контроль за мочеиспусканием и дефекацией сохранен. Ориентировка неполная.
- Глубокое оглушение – преобладание состояния сна, иногда сменяющегося двигательным возбуждением. Сохранена способность выполнять элементарные команды, часто выполняемые до травмы. Сразу следует мгновенное истощение. Координированная реакция на боль сохранена, на другие раздражители изменена. Контроль за мочеиспусканием и дефекацией ослаблен.
- Сопор – глубокое угнетение сознания с сохранностью координированных защитных реакций и открыванием глаз на боль. Патологическая сонливость.
Команды не выполняются. Неподвижность или автоматизированные рефлекторные движения. Реакция на болевые раздражители имеется. Кратковременно открывает глаза на болевые раздражители, резкий звук. Зрачковые, глотательный и глубокие рефлексы сохранены. Контроль за сфинктерами нарушен. Витальные функции сохранены, либо имеются нарушения по одному параметру.
- Кома – нарушение с полной утратой восприятия окружающего мира и самого себя. Кому по тяжести подразделяют на 3 степени: умеренную (I), глубокую (II), запредельную (III):
- Умеренная кома (I) – неразбудимость, отсутствие каких-либо реакций на внешние раздражители, кроме некоординированных защитных движений на болевые раздражители по типу отдергивания конечности. Глаза на боль не открываются. Зрачковые и роговичные рефлексы обычно сохранены. Брюшные рефлексы угнетены, сухожильные вариабельны. Могут появляться патологичные рефлексы. Глотание затруднено, защитные рефлексы верхних дыхательных путей сохранены. Контроль за сфинктерами нарушен. Дыхательные и кардиальные расстройства умеренные.
- Глубокая кома (II) – отсутствие каких-либо реакций на любые раздражители, лишь на сильные болевые раздражители могут появиться экстензорные движения в конечностях. Разнообразные изменения мышечного тонуса: от генерализованной горметонии до диффузной гипотонии с диссоциацией по оси менингеальных симптомов (исчезновение ригидности мышц затылка). Гипо- и арефлексия без двустороннего фиксированного мидриаза. Угрожающее нарушение витальных функций по нескольким параметрам.
- Запредельная кома (III) – фиксированный двусторонний мидриаз (расширение зрачка), неподвижность глазных яблок. Тотальная арефлексия, диффузная мышечная атония. Грубейшие нарушения витальных функций – критические расстройства ритма и частоты дыхания или апноэ, сердечные аритмии с нарушением гемодинамики, артериальная гипотензия.
Оценка состояния пациента может быть полной лишь при использовании не менее трех слагаемых состояния: уровня нарушения сознания, состояния витальных функций и неврологического статуса.
Оценка витальных функций заканчивается одной из следующих формулировок:
- нарушения отсутствуют – дыхание нормальное, пульс и артериальное давление в пределах нормы, температура тела не выше 39,0° С;
- начальные нарушения – умеренная брадикардия или умеренная тахикардия, умеренное тахипноэ, умеренная артериальная гипертензия или гипотония, субфебрилитет;
- выраженные нарушения – резкое тахипноэ или брадипноэ, тахикардия или брадикардия, артериальная гипертензия или гипотония, гипертермия или гипотермия;
- грубые нарушения – крайняя степень тахипноэ или брадипноэ, брадикардия или тахикардия, артериальная гипертензия, гипертермия свыше 39,0° С;
- критические нарушения – патологический ритм дыхания или апноэ,
- снижение артериального давления (систолического) менее 90 мм. рт. ст.,
- гипертермия свыше 40° С или гипотермия.
Основные инструментальные методы исследования в диагностике черепно-мозговой травмы:
- рентгенологические методы занимают одно из ведущих мест: краниография, ангиография, пневмоэнцефалография, компьютерная томография и спиральная компьютерная томография (трехмерная КТ реконструкция);
- электрофизиологические методы: электроэнцефалография и методика коротколатентных вызванных потенциалов;
- ультразвуковые методы: эхоэнцефалография широко применяется в практике лечения собак карликовых пород;
- магнитно-резонансная томография;
- хирургические методы: спинномозговая пункция, вентрикулярная пункция, вентрикулоскопия, биопсия мозга, методика поисковых фрезевых отверстий и эксплоративная краниотомия;
- офтальмоскопия;
- отоскопия.
Диагностика гематом ЭЭГ
При тяжелом ушибе головного мозга, сочетающемся с внутричерепным кровотечением, формируются гематомы (Угрюмов В. М., Зотов Ю. В., 1970). Своевременное распознавание, правильная топическая диагностика гематом в целях их оперативного удаления играют основную роль в предотвращении нарушений жизненно важных функций. В современных условиях неврологической клиники, наряду с различного рода клиническими и контрастными исследованиями, широко используется метод электроэнцефалографии. Трудности топической диагностики гематом по данным ЭЭГ определяются в первую очередь тем, что травма головного мозга всегда сопровождается общими генерализованными перестройками биопотенциалов, отражающими нарушение функционального взаимодействия стволовых и корковых структур, на фоне которых локальные изменения, обусловленные гематомой, могут быть замаскированы. Вовлечение в патологический процесс структур стволового отдела мозга может выражаться в виде усиления явлений синхронизации ритмов на ЭЭГ или же, наоборот, в виде выраженной картины десинхронизации. Оценивая эти данные, можно предполагать либо о непосредственном воздействии травмы на функцию неспецифических образований головного мозга, их ирритации (усиление восходящих влияний синхронизирующих или десинхронизирующих систем), либо о блокаде одной системы, на фоне которой ярче проявления другой (Боева Е. М., 1968; Малышева Т. С., Введенская И. В., Ерофеев Н. П., 1970; Овнатанов Б. С., 1970). К тому же наличие самой гематомы может оказаться фактором, воздействующим рефлекторным путем на рецепторные аппараты сосудов и оболочки головного мозга и тем самым усиливающим общие изменения на ЭЭГ. Особенности изменений биопотенциалов при внутричерепных кровоизлияниях зависят от локализации последних (эпидурально, субдурально, интрацеребрально). Эпидуральные гематомы сопровождаются нерезко выраженными изменениями ЭЭГ, основной бета-ритм может быть сохранен, и лишь незначительная межполушарная асимметрия за счет депрессии его способствует уточнению стороны расположения гематомы. Особенно следует подчеркнуть отсутствие в этих случаях вспышек синхронизированной активности, что позволяет исключить воздействие патологического процесса на стволовые образования головного мозга. В остром периоде тяжелой травмы черепа и головного мозга возможны и более значительные изменения биопотенциалов. На ЭЭГ при полном отсутствии нормальной бета-активности и наличии низкоамплитудных медленных дельта- и тета-волн большого периода регистрируются потенциалы в диапазоне бета-частот с высокой амплитудой. При этом локально-диагностическим признаком эпидуральной гематомы может быть область исчезновения частых ритмов и преобладание периодов медленных волн в этой зоне. По электроэнцефалографическим данным уточнение локализации гематом в пределах полушария может быть затруднено, более того, имеются данные, указывающие на возможность преобладания нарушений биоэлектрической активности на стороне, противоположной субдуральной гематоме, что связывается с повреждением вещества головного мозга по типу противоудара. Особенности изменений биоэлектрической активности головного мозга при интрацеребральных гематомах зависят от глубины их расположения. При поверхностных гематомах отмечается выраженное угнетение активности в пораженном полушарии, а иногда и в обоих. Длительное существование гематомы приводит к особенно значительному угнетению биопотенциалов, на фоне которого очаговые изменения в зоне гематомы проявляются нечетко. При расположении гематомы в более глубоких отделах полушарий и на основании мозга в картине ЭЭГ появляются диффузные нерегулярные медленные волны полиморфного характера с четким преобладанием их выраженности на стороне локализации гематомы.
В отдельных случаях в связи с обширностью и нечеткостью границ очаговых изменений могут возникать затруднения в долевой локализации гематомы. Одним из признаков глубоко расположенных внутримозговых гематом могут явиться вспышки распространенной синхронизированной активности, обусловленные воздействием патологического процесса на срединные структуры головного мозга.
Затруднения ЭЭГ-диагностики гематом могут быть связаны также с наличием гигром, контузионных очагов, отека мозга, вызывающих на энцефалограмме локальные изменения. Дифференциальная диагностика с гематомами в этих случаях может быть осуществлена лишь при динамическом наблюдении: при ушибах головного мозга очаговые изменения могут уменьшаться, а при гематомах – нарастать, но только при сохранении гематомы.
ЧМТ: гематома после травмы
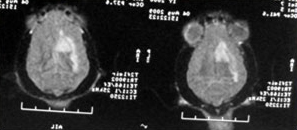 1. МРТ собаки породы той-терьер после травмы (падение гладильной доски на голову). Видно усиление сигнала по причине развития гематомы и отека головного мозга.
1. МРТ собаки породы той-терьер после травмы (падение гладильной доски на голову). Видно усиление сигнала по причине развития гематомы и отека головного мозга.
2. ЭЭГ исследование данного пациента
Протокол обследования
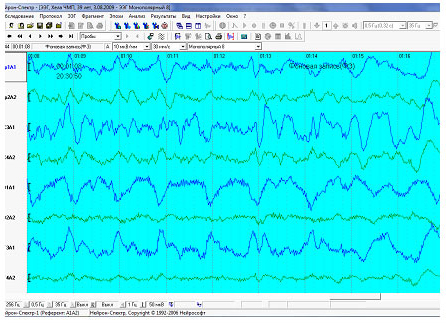 Пациент: Хела. ЧМТ.
Пациент: Хела. ЧМТ.
Дата обследования: 3.08.2009
Монтаж: Монополярный 8
Фоновая запись
Над обоими полушариями наблюдается низкочастотный бета-ритм частотой 14–20 Гц амплитудой до 19 мкВ слева (до 21 мкВ справа).
Над обоими полушариями наблюдается высокочастотный бета-ритм частотой 20–35 Гц амплитудой до 62 мкВ слева (до 34 мкВ справа).
Бета-ритм доминирует в средне-височном-T3A1 отведении слева и в затылочном- O2A2 отведении справа.
Над обоими полушариями видны медленные волны дельта-диапазона во всех отведениях амплитудой до 363 мкВ слева и до 220 мкВ справа.
Над обоими полушариями видны медленные волны тета-диапазона в центральном - C3A1 (95 мкВ) отведении слева и в центральном - C4A2 (73 мкВ) отведении справа.
Спектр и частоты (Бета_В)
Фоновая запись
| Отв. |
А макс. |
S макс. |
А средн. |
S средн. |
А полн. |
S полн. |
F домин. |
F средн. |
Индекс |
| Fp1A1 |
2,4 |
6,0 |
0,9 |
1,2 |
54 |
71 |
25,3 |
25,5 |
2 |
| Fp2A2 |
1,6 |
2,4 |
0,71 |
0,62 |
43 |
37 |
26 |
26,5 |
2 |
| C3A1 |
2,8 |
8,0 |
1,1 |
1,6 |
64 |
99 |
24,3 |
25,3 |
1 |
| C4A2 |
2,2 |
5,0 |
0,77 |
0,78 |
46 |
47 |
26 |
26,3 |
1 |
| O1A1 |
3,6 |
12 |
1,3 |
2,4 |
82 |
148 |
26 |
26,3 |
4 |
| O2A2 |
2,6 |
6,7 |
0,88 |
1,1 |
53 |
67 |
30,3 |
29 |
3 |
| T3A1 |
4,8 |
23 |
1,5 |
3,0 |
90 |
183 |
24,3 |
25,3 |
3 |
| T4A2 |
1,6 |
2,6 |
0,63 |
0,52 |
38 |
31 |
26 |
26,8 |
3 |
А – амплитуда спектра, мкВ/с; S – мощность спектра, мкВ^2/с^2; F – частота, Гц; Индекс ритма – %
Спектр и частоты (Дельта)
Фоновая запись
| Отв. |
А макс. |
S макс. |
А средн. |
S средн. |
А полн. |
S полн. |
F домин. |
F средн. |
Индекс |
| Fp1A1 |
40 |
1616 |
12 |
276 |
174 |
3871 |
1 |
1 |
94 |
| Fp2A2 |
22 |
501 |
10 |
133 |
143 |
1867 |
0,8 |
1,8 |
86 |
| C3A1 |
94 |
8922 |
26 |
1241 |
370 |
17385 |
2 |
2 |
94 |
| C4A2 |
65 |
4321 |
16 |
513 |
235 |
7193 |
2 |
2 |
91 |
| O1A1 |
28 |
799 |
12 |
240 |
175 |
3360 |
1,8 |
1,8 |
89 |
| O2A2 |
25 |
653 |
9,3 |
125 |
130 |
1761 |
1,5 |
1,5 |
89 |
| T3A1 |
51 |
2637 |
14 |
384 |
207 |
5389 |
1 |
1 |
94 |
| T4A2 |
23 |
556 |
6,7 |
72 |
93 |
1013 |
2 |
2 |
82 |
А – амплитуда спектра, мкВ/с; S – мощность спектра, мкВ^2/с^2; F – частота, Гц; Индекс ритма – %
Повторная ЭЭГ той-терьера
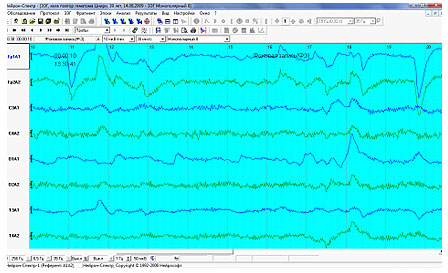
Протокол повторного обследования
Пациент: Хела. Повтор, гематома.
Дата обследования: 14.08.2009
Монтаж: Монополярный 8
Фоновая запись
Над обоими полушариями наблюдается низкочастотный бета-ритм частотой 14–20 Гц амплитудой до 28 мкВ слева (до 27 мкВ справа).
Над обоими полушариями наблюдается высокочастотный бета-ритм частотой 20–35 Гц амплитудой до 25 мкВ слева (до 46 мкВ справа).
Бета-ритм доминирует в центральных (C3A1, C4A2) отведениях.
Над обоими полушариями видны медленные волны дельта-диапазона в передне-лобном Fp1A1 (379 мкВ), центральном - C3A1 (51 мкВ), затылочном - O1A1 (86 мкВ), средне-височном - T3A1 (94 мкВ) отведениях слева и в передне-лобном - Fp2A2 (187 мкВ), центральном - C4A2 (66 мкВ) отведениях справа.
Над левым полушарием видны медленные волны тета-диапазона в передне-лобном - Fp1A1 (132 мкВ) отведении.
Спектр и частоты (Дельта)Фоновая запись
| Отв. |
А макс. |
S макс. |
А средн. |
S средн. |
А полн. |
S полн. |
F домин. |
F средн. |
Индекс |
| Fp1A1 |
2,4 |
6,0 |
0,9 |
1,2 |
54 |
71 |
25,3 |
25,5 |
2 |
| Fp2A2 |
1,6 |
2,4 |
0,71 |
0,62 |
43 |
37 |
26 |
26,5 |
2 |
| C3A1 |
2,8 |
8,0 |
1,1 |
1,6 |
64 |
99 |
24,3 |
25,3 |
1 |
| C4A2 |
2,2 |
5,0 |
0,77 |
0,78 |
46 |
47 |
26 |
26,3 |
1 |
| O1A1 |
3,6 |
12 |
1,3 |
2,4 |
82 |
148 |
26 |
26,3 |
4 |
| O2A2 |
2,6 |
6,7 |
0,88 |
1,1 |
53 |
67 |
30,3 |
29 |
3 |
| T3A1 |
4,8 |
23 |
1,5 |
3,0 |
90 |
183 |
24,3 |
25,3 |
3 |
| T4A2 |
1,6 |
2,6 |
0,63 |
0,52 |
38 |
31 |
26 |
26,8 |
3 |
А – амплитуда спектра, мкВ/с; S – мощность спектра, мкВ^2/с^2; F – частота, Гц; Индекс ритма – %
Спектр и частоты (Бета В)
Фоновая запись
| Отв. |
А макс. |
S макс. |
А средн. |
S средн. |
А полн. |
S полн. |
F домин. |
F средн. |
Индекс |
| Fp1A1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
| Fp2A2 |
2,9 |
8,6 |
0,88 |
1,0 |
53 |
63 |
21,7 |
23,3 |
1 |
| C3A1 |
1,8 |
3,1 |
0,72 |
0,67 |
43 |
40 |
24,5 |
24,5 |
13 |
| C4A2 |
3,1 |
9,8 |
1,1 |
1,8 |
67 |
108 |
23,5 |
23,8 |
19 |
| O1A1 |
1,1 |
1,1 |
0,41 |
0,23 |
25 |
13 |
21 |
24 |
2 |
| O2A2 |
3,4 |
11 |
1,0 |
1,5 |
61 |
92 |
24 |
24 |
34 |
| T3A1 |
1,5 |
2,2 |
0,46 |
0,29 |
28 |
17 |
24,5 |
26,3 |
3 |
| T4A2 |
2,6 |
6,7 |
0,86 |
1,1 |
52 |
64 |
24 |
24 |
29 |
А – амплитуда спектра, мкВ/с; S – мощность спектра, мкВ^2/с^2; F – частота, Гц; Индекс ритма – %
Мы видим нормализацию функции головного мозга, уменьшение мощности спектра в дельта-диапазоне более чем в десять раз, уменьшение индекса дельта-ритма во всех участках головного мозга, а также увеличение индекса и мощности спектра бета-ритма. Вышеописанные изменения свидетельствуют о стабилизации состояния и наиболее вероятном процессе восстановления функции головного мозга.
Данный пациент клинически полностью восстановился.
Клинический случай. Йоркширский терьер Ляля, сука, возраст 1 год, травма головного мозга. Со слов хозяина сутки назад была покусана другой собакой. При осмотре кусаная рана в средней части левого полушария. Собака в состоянии сопора.
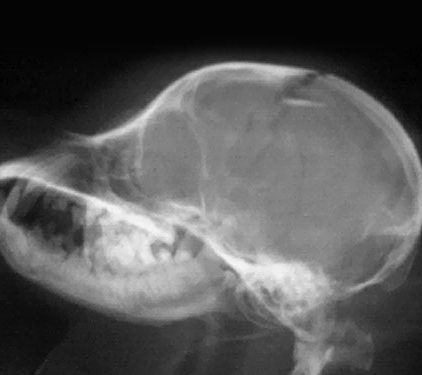
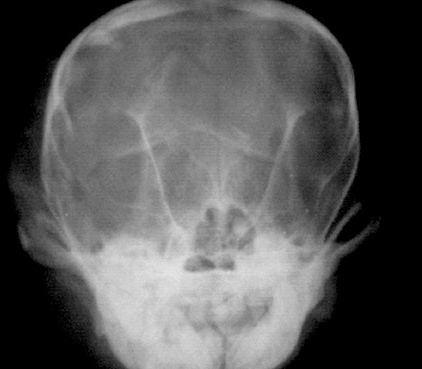 Слева - Рентгенограмма: перелом костей черепа у йорка. Латеральная проекция.
Слева - Рентгенограмма: перелом костей черепа у йорка. Латеральная проекция.
Справа - Рентгенограмма: перелом костей черепа у йорка. Фронтальная проекция.

 Йорк Ляля. Проводится снятие ЭЭГ у собаки перед операцией.
Йорк Ляля. Проводится снятие ЭЭГ у собаки перед операцией.
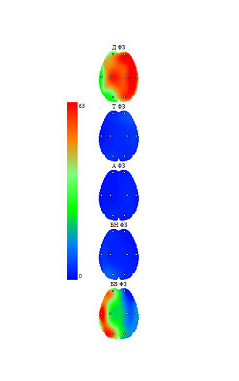
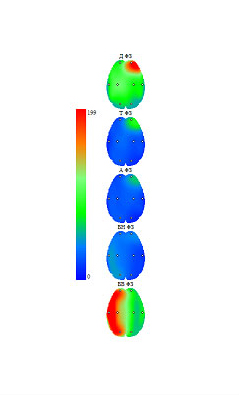
Слева - Индекс ритма. Хорошо заметна асимметрия, преобладание высокочастотного бета-ритма в левом полушарии.
Справа - Полная максимальная амплитуда спектра мкВ/с, преобладание в левом полушарии.
Протокол обследования
Пациент: Йорк Ляля. ЧМ–травма.
Дата обследования: 1.01.2010
Отделение: неврологическое
Монтаж: Монополярный 8
Фоновая запись
Над обоими полушариями наблюдается низкочастотный бета-ритм частотой 14–20 Гц амплитудой до 47 мкВ слева (до 70 мкВ справа).
Над обоими полушариями наблюдается высокочастотный бета-ритм частотой 20–35 Гц амплитудой до 180 мкВ слева (до 94 мкВ справа).
Бета-ритм доминирует в средне-височных (T3A1, T4A2) отведениях.
Над обоими полушариями видны медленные волны дельта-диапазона во всех отведениях амплитудой до 106 мкВ слева и до 218 мкВ справа.
Над правым полушарием видны медленные волны тета-диапазона в передне-лобном Fp2A2 (143 мкВ) отведении.
В средне-височном-T3A1 отведении левого полушария зафиксированы спайки амплитудой до 198 мкВ.
Спектр и частоты (Бета_В)
Фоновая запись
| Отв. |
А макс. |
S макс. |
А средн. |
S средн. |
А полн. |
S полн. |
F домин. |
F средн. |
Индекс |
| Fp1A1 |
8,4 |
71 |
2,9 |
12 |
176 |
744 |
26,7 |
27,8 |
47 |
| Fp2A2 |
2,3 |
5,5 |
1,2 |
1,6 |
72 |
99 |
27,3 |
27,3 |
1 |
| C3A1 |
8,9 |
78 |
3,0 |
13 |
182 |
801 |
25,8 |
27,8 |
34 |
| C4A2 |
2,5 |
6,2 |
0,98 |
1,3 |
60 |
78 |
27,3 |
27,3 |
8 |
| O1A1 |
7,9 |
63 |
3,1 |
12 |
188 |
764 |
26,7 |
28,3 |
58 |
| O2A2 |
2,6 |
6,6 |
1, |
1,3 |
60 |
81 |
27 |
27,8 |
16 |
| T3A1 |
11 |
136 |
4,2 |
24 |
258 |
1510 |
26,5 |
27,3 |
69 |
| T4A2 |
3,4 |
11 |
1,3 |
2,1 |
76 |
127 |
31,5 |
27 |
15 |
А – амплитуда спектра, мкВ/с; S – мощность спектра, мкВ^2/с^2; F – частота, Гц; Индекс ритма – %
Лечение ЧМТ
У большинства пациентов с черепно-мозговой травмой отмечаются вторичные ишемические поражения. Наиболее частыми причинами их являются скомпрометированное интракраниальное перфузионное давление (как вследствие снижения системного давления, так и вследствие повышения внутричерепного), гипертермия или гипотермия, гипокапния и снижение SvO2 в яремной вене.
Внутричерепная гипертензия, не связанная с изменением системного артериального давления или внутричерепной гематомой, отмечается в основном через 48 часов. Следовательно, усилия, направленные на поддержание адекватного перфузионного давления мозга, следует сконцентрировать на контроле за системным артериальным давлением, своевременном удалении внутричерепных гематом на начальном этапе и на контроле за внутричерепным давлением на последующих этапах.
Приоритетными задачами у пациентов с тяжелой черепно-мозговой травмой следует считать поддержание адекватного церебрального перфузионного давления и обеспечение адекватного кислородного бюджета головного мозга.
Для оценки адекватности проводимой интенсивной терапии тяжелой черепно-мозговой травмы определен базовый комплекс методов, который включает динамический контроль следующих показателей:
- внутричерепное давление;
- среднее АД;
- исследование КТ, МРТ головного мозга в динамике;
- оценка газового состава крови – PaO2 и PaCO2;
- температура тела.
Каждый из оцениваемых параметров является отражением факторов вторичного повреждения мозга в остром периоде ЧМТ. Помимо перечисленных, в диагностический комплекс входят широко используемые методы мониторинга (ЭКГ, пульсоксиметрия, капнография, измерение центрального венозного давления, оценка водного баланса, основного обмена).
В программе лечения пациентов с тяжелой черепно-мозговой травмой выделяют экстрацеребральные и интрацеребральные мероприятия, выполнение которых достигается решением следующих задач:
Экстрацеребральные мероприятия:
- поддержание адекватного дыхания;
- стабилизация центральной гемодинамики;
- коррекция нарушений гомеостаза;
- поддержание метаболических потребностей организма.
Интрацеребральные мероприятия:
- управление внутричерепными объемными соотношениями (внутричерепная гипертензия, отек головного мозга, дислокационный синдром, нарушение ликвороциркуляции);
- управление церебральной перфузией (церебральное перфузионное давление, церебральный вазоспазм, предупреждение вторичной ишемии мозга на различных уровнях);
- церебральная протекция (медикаментозная и метаболическая).
Основная задача – не допустить развития артериальной гипотензии и гиповентиляции, поскольку они увеличивают летальность.
Выполнение задачи подчиняется правилу “ABC”:
- А – airway – обеспечение доступа воздуха и восстановление проходимости дыхательных путей;
- B – breathing – обеспечение адекватного дыхания;
- С – circulation – поддержание системной гемодинамики.
- Обеспечение адекватного газообмена достигается надежным обеспечением проходимости дыхательных путей, своевременным началом вспомогательной искусственной вентиляции легких или искусственной вентиляции легких и применением в процессе проведения респираторной поддержки кислородно-воздушных смесей с минимально достаточным содержанием кислорода. У пациентов в состоянии комы абсолютным приоритетом является интубация трахеи. При этом тенденция к ухудшению состояния пациента и увеличению гипоксии является абсолютным показанием к интубации и переводу пациента на ИВЛ.
В клинически сомнительных ситуациях вопрос решается в пользу интубации трахеи и проведения вспомогательных методов вентиляции легких либо искусственной вентиляции легких.
Условия интубации трахеи:
- Для пациентов с ЧМТ применяют особую методику интубации трахеи с целью минимизирования прессорных гемодинамических реакций и повышения ВЧД:
- преоксигенация 100% кислородом в течение 5 минут;
- премедикация – атропина сульфат 0,01 мг/кг;
- седация препаратами короткого действия – пропофол;
Индукция и релаксация проводятся стремительно.
- интубация трахеи, контроль положения интубационной трубки, раздутие манжеты;
- надежная фиксация интубационной трубки.
- Поддержание системной гемодинамики.
Крайне важным является стабилизация гемодинамических параметров (систолическое АД не менее 150 мм. рт. ст.). Коррекция гемодинамических нарушений должна отвечать следующим требованиям:
- эффективность: достоверное улучшение макрогемодинамических (АД) и микроциркуляционных показателей (внешние проявления трофической функции кровотока);
- безопасность и снижение риска неблагоприятных реакций.
Инфузионная терапия проводится кристаллоидными и коллоидными растворами и, по показаниям, вазоактивными и инотропными препаратами (предпочтительно фенилэфрин или норэпинефрин). Последними исследованиями продемонстрирована высокая эффективность гипертонического раствора натрия хлорида (NaCl 7,5%), особенно в сочетании с декстранами или ГЭКами. Инфузия раствора NaCl 7,5% быстро восстанавливает ОЦК, не вызывая повышения ВЧД.
Рекомендуемая доза 2–4 мл/кг болюсно за 2–5 минут. Однако чрезмерное повышение АД (АД сист. следует удерживать на уровне 100–150 мм. рт. ст.) может привести к усилению скрытого кровотечения.
Экстрацеребральные мероприятия:
а) Обеспечение адекватного газообмена. Необходимо обеспечить полную проходимость дыхательных путей и адекватный газообмен. Интубация трахеи проводится по вышеуказанным правилам. Сопор и кома (независимо от ее тяжести) являются абсолютными показаниями к интубации трахеи! Ингаляция О2 не проводится без специальных показаний (снижений рО2 и SatO2 ниже нормы), поскольку для пациентов с ЧМТ характерен респираторный алкалоз. Показания к проведению вспомогательной искусственной вентиляции легких или искусственной вентиляции легких у больных с ЧМТ:
- апноэ, остро возникшие нарушения ритма дыхания, тахипноэ;
- гиперкапния (РаСО2 > 45 мм. рт. ст);
- гипокапния (РаСО2 < 30 мм. рт. ст);
- угрожающая гиповентиляция – снижение жизненной емкости легких < 15 мл/кг, дыхательный объем < 5 мл/кг, Vd/Vt (отношение объема мертвого пространства к дыхательному объему) > 0,6;
- недостаточная артериальная оксигенация:
а) стойкий цианоз при FiO2 (фракция кислорода во вдыхаемой газовой смеси) > 0,6;
б) РаО2 < 60 мм. рт. ст. при FiO2 > 0,6;
в) альвеолярно-артериальная разница по О2 > 300 мм. рт. ст при FiO2 > 1,0;
– гипертермия более 3 часов.
При отсутствии специальных показаний ИВЛ проводится в режиме нормовентиляции:
- частота дыхания – 16–18 в мин.;
- МОД – 100–120 мл/кг;
- ДО – 6–8 мл/кг;
- РаО2 = 94–100 мм. рт. ст;
- SaO2 = 96–98%;
- РаСО2 = 36–40 мм. рт. ст.
Показания к плановой трахеостомии:
- отсутствие положительной неврологической симптоматики более 2 суток от момента травмы;
- наличие стойких псевдобульбарных или бульбарных нарушений, особенно в сочетании с продуктивными воспалительными изменениями со стороны голосовых связок и надгортанника;
- необходимость пролонгированной (более 7–10 суток) ИВЛ.
Нормализация показателей системной и периферической гемодинамики. С целью восполнения дефицита ОЦК у пациентов с ЧМТ традиционно используются кристаллоидные (р-р Рингера, р-р NaCl 0,9%) и искусственные коллоидные растворы (гидроксиэтилированные крахмалы), как правило, в соотношении 3:1. При необходимости на фоне восстановления дефицита ОЦК возможно применение инотропных и вазоактивных препаратов.
Бессолевые водные растворы (р-р глюкозы 5%) у пациентов с ЧМТ не используются не только в остром периоде, но и при любых состояниях, вызывающих отек головного мозга, так как при любом из пяти видов отека мозга нет необходимости насыщать внутриклеточное и интерстициальное пространства водой. Известно, что при введении 250 мл 5% глюкозы только 18 мл остается и пополняет собой ОЦК (объем циркулирующей крови), 70 мл – в интерстициальном пространстве, и 162 – во внутриклеточном объеме. Более того, 5% глюкоза сама может вызвать отек головного мозга при неправильном ее применении у пациентов без ЧМТ.
Пять видов отека головного мозга:
- Вазогенный– наиболее распространенный вид отека. Возникает при нарушении функций гематоэнцефалического барьера, вследствие чего происходит повышение гидратации глии. Основными причинами данного вида отека являются метаболические нарушения транспортных систем эндотелия, артериальная гипертензия, гипертермия, гиперкапния, неоваскуляризация опухолевого ложа.
- Гидроцефалический – отек головного мозга, возникающий при блокаде путей оттока ликвора. Основные причины: воспалительные процессы и кровоизлияния в желудочковую систему мозга, объемные интракраниальные процессы, вызывающие деформацию головного мозга.
- Осмотический – отек головного мозга, возникающий при нарушении осмотических градиентов внутриклеточного и внутрисосудистого секторов при неповрежденном гематоэнцефалическом барьере. Основные причины: гиперпродукция вазопрессина, внутривенная нагрузка гипоосмолярными растворами, неадекватный гемодиализ, утопление в пресной воде, гиперволемия, полидипсия.
- Ишемический(реперфузионный) отек головного мозга обусловлен внутриклеточным накоплением жидкости вследствие гипоэргоза, блокады Na+K+–насоса и трансминерализации. Основной причиной данного вида отека является гипоксия любого генеза и постишемическая реперфузия, гипераммониемия, гипогликемия.
- Цитотоксический – внутриклеточный отек головного мозга, возникающий при блокаде дыхательной цепи митохондрий. Основные причины: вирусные инфекции, отравление угарным газом, цианидами, продуктами распада гемоглобина (лизис гематом).
Применение растворов глюкозы, даже 20 и 40%, особенно при нарушениях мозгового кровообращения и хирургических вмешательствах, в настоящее время не рекомендуется, поскольку они усугубляют ацидоз в тканях головного мозга. Единственным показанием для интраоперационного использования растворов глюкозы является профилактика и лечение гипогликемии. При наличии угрожающей гипогликемии необходимо использовать высококонцентрированные (15–40%) растворы глюкозы в соответствующих дозировках. Плановая инфузионная терапия требует ведения пациента в режиме умеренной дегидратации (до минус 10 мл/кг сутки).
Блокада биологически активных веществ достигается введением ингибиторов протеолиза (контрикал 800–2000 АтрЕ/кг/сутки), блокаторов Са2+–каналов (изоптин, верапамил, финоптин в дозе 10–20 мг/сутки). Применение селективного церебрального Са2+–блокатора нимодипина (нимотоп) особенно показано при массивных травматических субарахноидальных кровоизлияниях для предупреждения и лечения связанного с ними церебрального вазоспазма и развития вторичной ишемии. Коррекция водно-электролитного обмена осуществляется по данным лабораторных исследований. Осмолярность плазмы 280–310 мОсм/л свидетельствует о правильно подобранной инфузионной терапии. Коллоидно-онкотическое давление необходимо удерживать не ниже 18 мм. рт. ст. Нормализация микроциркуляции и профилактика тромбоэмболических осложнений: пентоксифиллин (трентал) 100–200 мг/сутки; гепарин 4 раза в сутки (предпочтительнее низкомолекулярные гепарины: фраксипарин, клексан). Борьба с гиперметаболизмом.
Энтеральное питание пациентов с ЧМТ следует начинать как можно раньше, но не позднее 72 часов после травмы, постепенно наращивая объем, и к концу недели обеспечивать 100%. Для энтерального питания целесообразно использовать корма промышленные и для приготовления зондового питания. До начала энтерального питания со вторых суток после ЧМТ начинают парентеральное питание. Для этого используют фармакопейные растворы аминокислот (Аминоплазмаль, Инфезол и т.п.).
Нормализация функции ЖКТ и профилактика язв ЖКТ, особенно после применения дексаметазона или метилпреднизолона. Возможно использование прокинетических средств: мотилиум, цизаприд (агонист серотониновых 5–НТ4–рецепторов) в соответствующих дозировках. У большинства пациентов с ЧМТ наблюдаются желудочно-кишечные кровотечения. Раннее энтеральное питание является наиболее предпочтительным методом их профилактики. Возможно применение сукральфата (препарата гастропротекторного действия без значительного влияния на секреторную активность).
Антибактериальная терапия. Прямым показанием для проведения антибиотикотерапии при черепно-мозговой травме являются наличие ран мягких тканей, открытые проникающие и непроникающие повреждения, субарахноидальное кровоизлияние, тяжелая черепно-мозговая травма, сопровождающаяся длительным нарушением сознания и витальными нарушениями, также сведения об отягощенном анамнезе в отношении воспалительных процессов внутренних органов. Антибактериальная терапия корректируется по результатам бактериологического исследования и антибиотикограммы.
Интрацеребральные мероприятия направлены на максимальное сохранение функционального состояния клеток головного мозга и уменьшение повреждения в зоне «полутени».
Нейропротекторная терапия подразумевает комплекс мероприятий, направленный на сохранение и восстановление клеток головного мозга. Это достигается путем коррекции гипоксии, снижения активности обменных процессов в клетках, стабилизации клеточных мембран в соответствии с фазностью течения травматической болезни головного мозга.
Целесообразно выделять антигипоксанты прямого и непрямого действия. Антигипоксанты прямого действия способны в условиях гипоксии корригировать физиологические процессы непосредственно на митохондриальном уровне (электронтранспортную функцию), активировать ферменты, облегчать поступление кислорода, восстанавливая аэробный энергетический обмен. В отличие от них антигипоксанты непрямого действия облегчают реакцию организма на гипоксию и опосредованно ускоряют нормализацию функции клеток в постгипоксический период в целом. Уменьшение интенсивности метаболических процессов достигается с помощью фармакологической защиты головного мозга от гипоксии.
Методика фармакологической защиты головного мозга состоит во внутривенном поочередном введении пропофола (медленно) и 20% раствора натрия оксибутирата (20 мг/кг на одно введение) с интервалом в 3 часа на протяжении 5–7 суток. Критерием для постепенного уменьшения доз препаратов фармакологической защиты головного мозга является появление положительной неврологической симптоматики в виде открывания глаз на болевой и звуковой раздражитель. При артериальной гипотензии проводится обязательная инотропная поддержка (допамин – не менее 5 мкг/кг/мин).
Проведение фармакологической защиты головного мозга сочетается с введением ноотропов, которые усиливают способность нервной клетки продуцировать энергию в условиях гипоксии и защищают мозг от ноцицептивного воздействия последней. Пирацетам или ноотропил назначают в дозе 0.3 г/кг в первые сутки, затем по 0,15 г/кг в сутки до первых признаков восстановления сознания, после чего дозу уменьшают до 0,1 г/кг, назначая препарат на протяжении от 1 до 3 месяцев после травмы. Возможно применение других нейропротекторов.
Антиноцицептивная защита – буторфанол, трамал.
Применение глюкокортикоидов – исследованиями I и II класса показано, что использование глюкокортикоидов не рекомендуется для снижения ВЧД и улучшения исходов у пациентов с тяжелой черепно-мозговой травмой.
Однако эффективность противоотечной терапии в нейрохирургии была показана рядом исследований при процессах, сопровождающихся формированием перифокального отека по вазогенному механизму. Рекомендуемая доза дексаметазона при внутримозговом кровоизлиянии с перифокальным отеком вокруг зоны кровоизлияния (по данным МРТ-исследования) – 2 мг/кг каждые 12 часов 3 суток с постепенной отменой в течение 14 дней.
Управление внутричерепными объемами
Центральное место в терапии тяжелой черепно-мозговой травмы занимает лечение отека головного мозга. Травматический отек головного мозга является универсальной реакцией воспалительного типа в ответ на ЧМТ, которая приводит к значительному нарастанию внутричерепной гипертензии в условиях избыточного скопления жидкости во вне- и внутриклеточном пространстве. Непременным условием проведения интенсивной терапии отека головного мозга является мониторинг внутричерепного и артериального давления, предпочтительно инвазивным методом. Стратегия лечения и профилактики отека головного мозга ориентирована на поддержание адекватного церебрального перфузионного давления (выше 100 мм. рт. ст.), что является также одной из основных целей интенсивной терапии в остром периоде ЧМТ:
- поддержание церебрального перфузионного давления допустимо за счет восстановления ОЦК и управляемой артериальной гипертензии, поскольку нет достоверных исследований, которые демонстрировали бы увеличение внутричерепной гипертензии или возрастания числа неблагоприятных исходов при использовании этих компонентов интенсивной терапии;
- снижение ЦПД ниже 90 мм. рт. ст длительностью более одного часа в остром периоде ЧМТ недопустимо, поскольку это приводит к возрастанию летальности.
Для реализации данной концепции необходимо придерживаться следующих правил:
- следовать от простого к сложному;
- четко обосновывать каждый шаг возрастания агрессивности интенсивной терапии.
Последовательность применения методов интенсивной терапии отека головного мозга при тяжелой черепно-мозговой травме.
Первая ступень:
- адекватная оксигенация;
- устранение гиперкапнии;
- устранение судорожных проявлений;
- устранение двигательного возбуждения;
- борьба с гипо- и гипертермией;
- устранение причин, нарушающих отток крови из полости черепа;
- мониторинг ВЧД;
- поддержание перфузионного давления.
Вторая ступень:
- фракционное выведение ликвора из желудочков мозга;
- умеренная гипервентиляция;
- болюсное или непрерывное введение маннитола.
Третья ступень:
- барбитуровый (пропофоловый) наркоз;
- умеренная гипотермия;
- глубокая гипервентиляция;
- гипертензивная терапия;
- декомпрессивная краниотомия.
К методам терапии внутричерепной гипертензии и коррекции центрального перфузионного давления относится гипервентиляция. Быстрое снижение ВЧД при проведении гипервентиляции сопоставимо с дренированием вентрикулярного ликвора. Эффект начинается через 15 секунд после начала гипервентиляции с максимумом через 30 минут. По применению гипервентиляции у пациентов с тяжелой черепно-мозговой травмой даны следующие рекомендации:
Следует избегать пролонгированной гипервентиляционной терапии (РаСО2 = 25 мм. рт. ст. или менее) при отсутствии повышения ВЧД после тяжелой ЧМТ.
Следует избегать использования профилактической гипервентиляционной терапии (РаСО2 < 35 мм. рт. ст) в течение 24 часов после тяжелой черепно-мозговой травмы, поскольку это может ухудшить церебральную перфузию в то время, когда мозговое кровообращение снижено. Гипервентиляционная терапия может быть необходима на короткий срок, когда отмечается острое ухудшение неврологического статуса, или на более длительный срок, если имеется устойчивая внутричерепная гипертензия в условиях проведения седативной, миорелаксирующей терапии, дренирования вентрикулярного ликвора и применения осмотических диуретиков. Условием проведения такой терапии является мониторинг насыщения кислородом крови в яремной вене; артерио-венозной (яремной) разницы содержания кислорода (AVDO2 – arterio-venous difference); церебральной оксиметрии и мозгового кровообращения, что может помочь в выявлении церебральной ишемии, если гипервентиляция приводит к снижению РаСО2 менее 30 мм. рт. ст. Расчет AVDО2 может производиться как путем инвазивного определения насыщения гемоглобина кислородом в крови сонной артерии и яремной вены, так и при использовании неинвазивных показателей. Для неинвазивной оценки насыщения гемоглобина кислородом в артериальной крови используется пульсоксиметрия, в венозной крови мозга – параинфракрасная спектроскопия (церебральная оксиметрия – rSO2). Возможность данного подхода объясняется следующим образом. С достаточной точностью можно считать насыщение гемоглобина в разных артериях одинаковым. Поэтому и неинвазивное определение этого показателя при помощи пульсоксиметрии близко к величине насыщения гемоглобина в артериях, снабжающих головной мозг. Церебральная оксиметрия отражает насыщение гемоглобина кислородом в ткани мозга (Kirkpatrick PJ, Czosnyka M, Pickard JD, 1996). Так как по морфологическим данным 80–85% крови в полости черепа является венозной (Mchedlishvili G, 1986, p. 42–95), то полагают, что оксиметрия определяет насыщение гемоглобина именно венозной крови. Увеличение AVDO2 может отражать как потенциальную опасность ишемических изменений из-за снижения кровотока, так и быть проявлением реальной ишемии нейронов с ростом потребления кислорода (Robertson CS, Contant CF, Gokaslan ZL, et al, 1992).
Осмотическая терапия
В настоящее время наиболее широкое применение имеет маннитол. Его вводят болюсно внутривенно из расчета 0,25–1,0 г/кг/сутки, разделив на 6 введений (интервал введения не должен превышать 4 часа – эффект «рикошета»), или непрерывной инфузией через инфузомат. Осмотическая терапия маннитолом сопоставима с эффектом гипертонических (3–7,5%) растворов хлорида натрия.
Лечебный наркоз
Лечебный наркоз может быть применен у гемодинамически стабильных больных с тяжелой черепно-мозговой травмой при наличии внутричерепной гипертензии, устойчивой к максимальному консервативному и хирургическому лечению, направленному на снижение внутричерепного давления. При проведении лечебного наркоза целесообразно контролировать артериовенозное насыщение кислородом поскольку существует опасность развития олигемической церебральной гипоксии.
Гипотермия
Гипотермия не только подавляет биоэлектрическую активность мозга, но и уменьшает базальные метаболические потребности, иными словами после появления на ЭЭГ изолинии метаболические потребности мозга продолжают снижаться (в отличие от анестетических препаратов). Умеренная гипотермия (до 35–36°С) защищает головной мозг от ишемии и сопровождается меньшими побочными явлениями (содержание креатинфосфата в таких условиях более чем удваивается).
Однако гипотермия, проводимая после ишемии, только отсрочивает гибель нейронов. Данные условия дают возможность не столько провести эффективную нейропротекцию, сколько увеличить продолжительность «терапевтического окна». Однако недостаточное число рандомизированных исследований не позволяет отнести данный метод к доказательным.
Противосудорожная терапия
Судорожные приступы условно подразделяются на ранние (в пределах 7 дней после ЧМТ) и поздние (более 7 дней после ЧМТ).
Не рекомендуется профилактическое использование фенобарбитала для предупреждения поздних посттравматических приступов.
Рекомендуется применение противосудорожных средств для предупреждения ранних судорожных приступов, но это не приводит к достоверному улучшению исходов при черепно-мозговой травме.
Осложнения и последствия ЧМТ
Осложнения черепно-мозговой травмы – это патологические состояния, возникающие в результате появления дополнительных факторов у пациента, перенесшего черепно-мозговую травму.
I. Черепно-мозговые осложнения:
- менингит;
- менингоэнцефалит;
- вентрикулит;
- эмпиема;
- абсцесс;
- остеомиелит;
- тромбозы синусов и вен мозга;
- отсроченные внутричерепные кровоизлияния;
- воспаление мягких тканей головы;
- некроз костей черепа и мягких тканей головы.
II. Внечерепные осложнения:
- Воспалительные:
- пневмонии;
- эндокардит;
- пиелонефрит;
- сепсис;
- Трофические:
- кахексия;
- пролежни;
- отеки;
- Другие осложнения:
- отек легких;
- жировая эмболия;
- тромбоэмболия;
- ДВС-синдром;
- желудочно-кишечные кровотечения.
Последствия черепно-мозговой травмы являются результатом эволюционно закрепленных процессов регенерации тканей и формируются в промежуточном и отдаленном периоде травматической болезни головного мозга. По морфологическому субстрату выделяют следующие последствия черепно-мозговой травмы:
- тканевые (дефекты и деформации черепа, атрофия и кисты мозговой паренхимы, мозговые грыжи, арахноидиты, оболочечно-мозговые рубцы, поражение черепно-мозговых нервов, инородные тела в полости черепа);
- ликвородинамические (гидроцефалия, гигрома, ликворные свищи, пневмоцефалия);
Ведущими в клиническом проявлении последствий черепно-мозговой травмы являются неврологический дефицит, психическая дисфункция, вегетативная дизрегуляция и эпилепсия.
Прогноз при черепно-мозговой травме
Более старший возраст является сильным и независимым фактором прогноза неблагоприятных исходов у травмированных. Наихудшие результаты наблюдаются у собак старше 7–10 лет.
По данным МРТ к прогностически неблагоприятным факторам относятся:
- наличие травматической патологии на первичных МРТ, выполненных в течение первых 24 часов;
- сдавление базальных цистерн на уровне среднего мозга;
- травматические субарахноидальные кровоизлияния;
- кровь в цистернах основания;
- распространенность субарахноидальных кровоизлияний по конвексу;
- смещение срединных структур.
Клинический пример
Собака породы чихуахуа получила черепно-мозговую травму при невыясненных обстоятельствах.
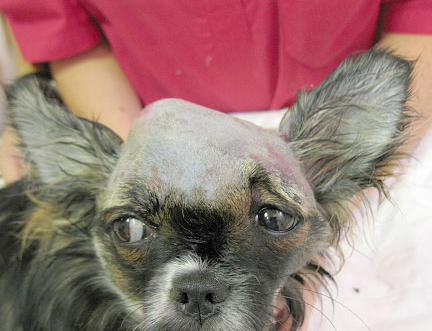
 Слева - Собака чихуахуа: перелом костей черепа, подкожная дислокация средней части правого полушария под кожу.
Слева - Собака чихуахуа: перелом костей черепа, подкожная дислокация средней части правого полушария под кожу.
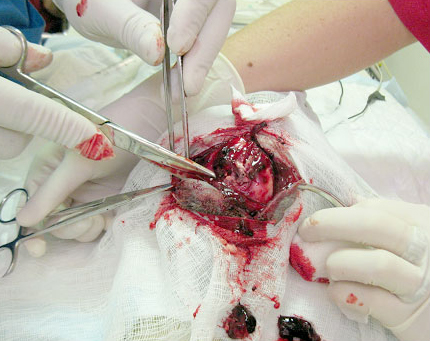
Справа - Интраоперационная фотография: вскрыта кожа, под кожей находятся ткани мозга, гематома.
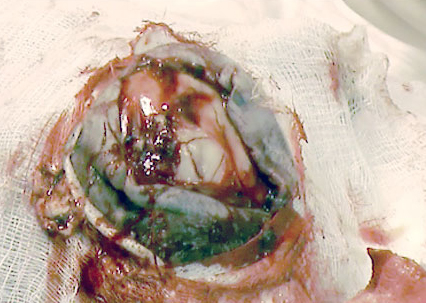
 Слева - После удаления тканей мозга.
Слева - После удаления тканей мозга.
Справа - Заключительный этап операции: наложение кожных швов.

 Слева - Собака через полгода после операции.
Слева - Собака через полгода после операции.
Справа - Полное восстановление функций головного мозга: нормальные реакции на окружающую среду

 1. МРТ собаки породы той-терьер после травмы (падение гладильной доски на голову). Видно усиление сигнала по причине развития гематомы и отека головного мозга.
1. МРТ собаки породы той-терьер после травмы (падение гладильной доски на голову). Видно усиление сигнала по причине развития гематомы и отека головного мозга. Пациент: Хела. ЧМТ.
Пациент: Хела. ЧМТ.

 Слева - Рентгенограмма: перелом костей черепа у йорка. Латеральная проекция.
Слева - Рентгенограмма: перелом костей черепа у йорка. Латеральная проекция.
 Йорк Ляля. Проводится снятие ЭЭГ у собаки перед операцией.
Йорк Ляля. Проводится снятие ЭЭГ у собаки перед операцией.
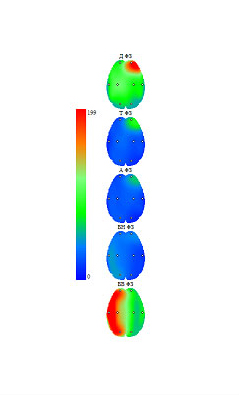

 Слева - Собака чихуахуа: перелом костей черепа, подкожная дислокация средней части правого полушария под кожу.
Слева - Собака чихуахуа: перелом костей черепа, подкожная дислокация средней части правого полушария под кожу.
 Слева - После удаления тканей мозга.
Слева - После удаления тканей мозга. 
 Слева - Собака через полгода после операции.
Слева - Собака через полгода после операции.