Соавтор: Сотников В. В., к.в.н., главный врач Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Для выбора оптимальной лечебной тактики и планирования нейрохирургического вмешательства при опухолях головного мозга важно получить наиболее полную диагностическую информацию не только о локализации и гистологических свойствах опухоли, но и о выраженности и характере перифокальных реакций мозга, существенно влияющих на клинические проявления заболевания. Значительный перифокальный отек снижает выживаемость пациентов при менингиомах (Motta L, Mandara MT, Skerritt GC.2012).
Наиболее общей, закономерно развивающейся реакцией при очаговых поражениях (прежде всего при опухолях мозга) является перифокальный отек, в основе развития которого лежит взаимодействие сосудистого и паренхиматозного фактора.
Принято различать вазогенный и цитотоксический отеки мозга, которые могут сочетаться и изменять количественные соотношения в динамике развития в зависимости от вызвавшей их причины. Перифокальный отек при опухолях мозга формируется за счет увеличения объема внеклеточного пространства в результате накопления в нем жидкости, поступающей из поврежденных глиальных клеток, и вследствие повышения проницаемости клеточной мембраны эндотелия капилляров в зоне, окружающей очаг поражения. Распространенность зоны перифокального отека определяется не только увеличением содержания в ней воды, но и степенью регионарной демиелинизации волокон белого вещества мозга.
Чем выше степень демиелинизации, тем меньше содержание липидов в перифокальной зоне и тем более выражены нарушения процессов окисления и фосфорилирования, а также явления отека мозга (Chan Р.Н., Fishmann R.A. 1978). В прогрессировании перифокального отека основную роль играют два механизма: поступление в белое вещество мозга белков плазмы и их связывание с глиальными элементами; увеличение дальнейшего поступления жидкости в перивазальное пространство вследствие осмотического градиента; а также, по аналогичному механизму, поступление жидкости из ликворной системы (Priden F.R., Tsayumu M., Reulen H.J. 1979; S.Reulen H.J., Graber S., Huber P., Jto U. 1988).
Многочисленные исследования в гуманной медицине, проведенные в Институте нейрохирургии АМН Украины, свидетельствуют о существовании динамических различий между явлениями отека и набухания мозга. Отек — это увеличение содержания свободной воды в межклеточных интерстициальных пространствах, а набухание — это накопление свободной воды в клетках и связанной воды в межклеточных пространствах. Для внутримозговых опухолей, особенно для глиом, характерно преобладание отека в перифокальной зоне (О.Ю.Чувашова 2000).
По мере увеличения объема опухоли и нарастания явлений внутричерепной гипертензии изменяется белковый состав как в очаге поражения, так и в перифокальной зоне, в которой эти сдвиги коррелируют со степенью злокачественности опухоли. При этом развиваются регионарные нарушения проницаемости гематоэнцефалического барьера, которые увеличивают цитотоксический отек. Определенную роль в этом процессе, по-видимому, играет обнаруженный недавно в головном мозге специфический белок — фактор проницаемости сосудов, стимулирующий ангиогенез в опухолевой ткани и повышающий проницаемость капилляров, причем обнаружена корреляция между концентрацией этого белка и выраженностью перифокального отека.
Изложенные предпосылки обосновывают поиски возможностей неинвазивного получения диагностической информации, характеризующей выраженность перифокального отека мозга при глиомах с учетом их локализации, величины и гистологических свойств.
По данным МРТ границы глиом и перифокального отека оптимально отличаются в Т2 режиме, поскольку интенсивность сигнала возрастает в зоне большого накопления экстрацеллюлярной жидкости. Рис 1(а)
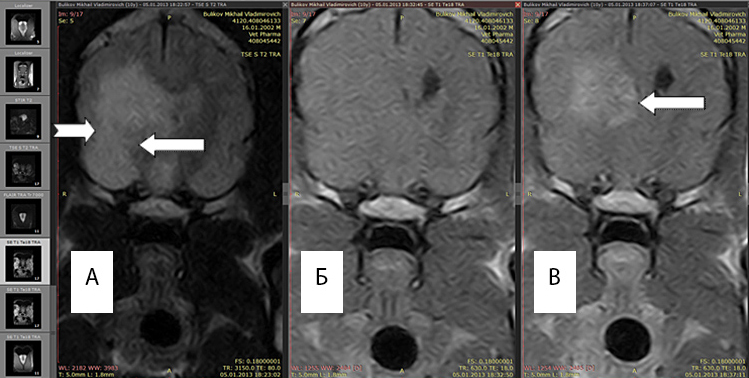 Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1Б. Т1 режим без введения контраста, отсутствует правый желудочек, имеется смещение срединных структур.
Рис. 1В. Т1 режим с введенным контрастным препаратом «Магневист». Регистрируется интенсивный сигнал от новообразования (обозначено стрелкой), перифокальный отек не виден.
Возможность выявления границ между опухолью и зоной перифокального отека повышается при повторном МРТ-исследовании после введения магнитоусиливающих препаратов (магневист). Поскольку магневист не проникает через неповрежденный гематоэнцефалический барьер, сопоставление томограмм, полученных до и после введения препарата, позволяет судить о регионарных нарушениях проницаемости барьера. Рис 1(A,B)
Это особенно отчетливо проявляется при астроцитомах типичной структуры, при которых функция гематопаренхиматозного барьера на границе опухоли и прилегающих участках мозга до определенного времени остается относительно сохранной, поэтому магневист не проникает в ткань опухоли.
В связи с этим зона гипоинтенсивности сигнала более отчетливо определяется в проекции астроцитомы, чем в области перифокального отека. Оценка размеров и распространения глиом более точна на МРТ, чем на КТ (Кобяков Г.Л., Коновалов А.Н., Личиницер М.Р. 2001; Коновалов A.Н., Корниенко В.Н. 1985; Коновалов А.Н., Корниенко В.Н., Пронин И.Н., 1997.; Yamada K., Soreusen A.G. 2000).
Существует большая точность и разрешающая способность МРТ в диагностике глиом полушарий мозга, этот метод не сопоставим с данными, полученными при КТ-исследовании. Он позволяет более точно определить вид опухоли, степень ее анаплазии и выраженность перифокального отека мозга, что имеет важное значение для выбора наиболее рациональной противоотечной терапии в процессе предоперационной подготовки и планирования хирургического вмешательства (рис. 2,3,4,5,6). На всех рисунках представлены справа результаты МРТ - изображения, а слева - КТ в аналогичных срезах.
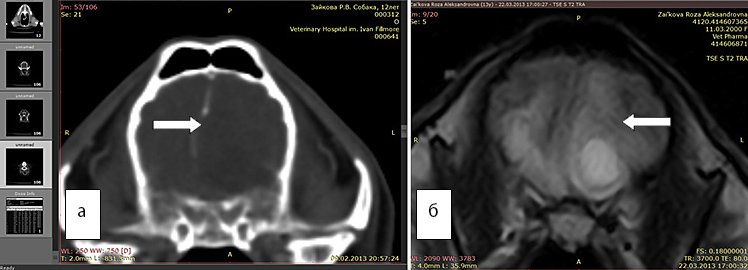 Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2б. МРТ. Хорошо виден перифокальный отек
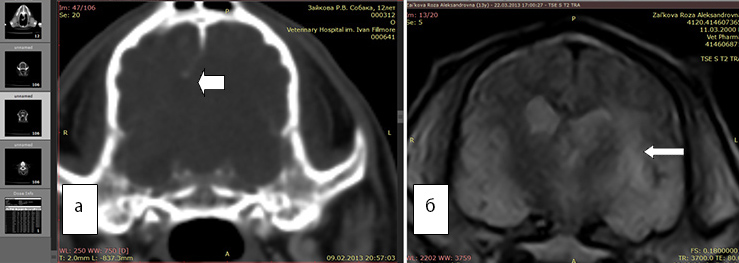 Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3б. МРТ. Хорошо виден перифокальный отек
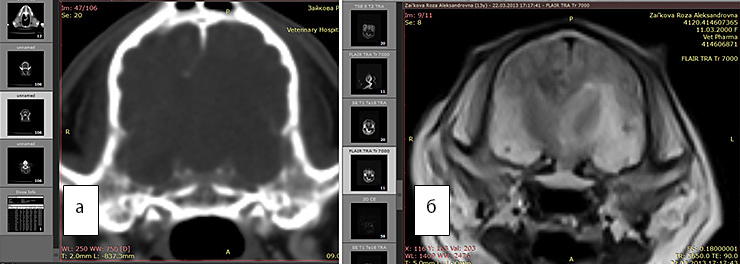 Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4б. МРТ. Хорошо виден перифокальный отек. FLAIR последовательность
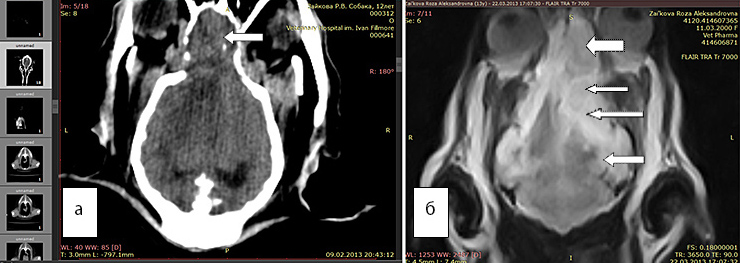 Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5б. МРТ. Видно новообразование (большая стрелка), отек наиболее хорошо виден в программе FLAIR (маленькие стрелки)
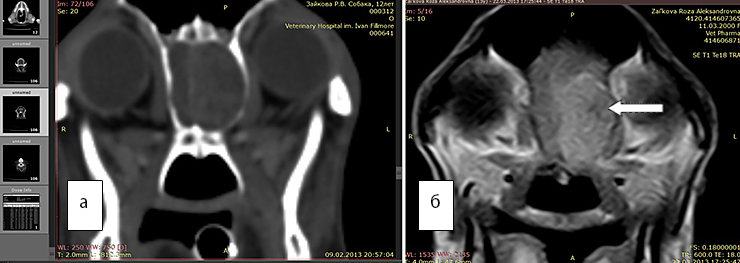 Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис. 6б. МРТ. Т1 режим с контрастом дает возможность гораздо точнее оценить объем новообразования, его границы
Представленные выше рисунки демонстрируют, что визуализация новообразования головного мозга, перифокального отека и его распространенности гораздо информативнее при использовании МРТ, чем КТ. Улучшить визуализацию помогает использование контраста, а также последовательного выполнения программ: для оценки перифокального отека целесообразно использовать FLAIR импульсную последовательность МРТ. Т2-взвешенные изображения, широко использующиеся для выявления патологических изменений, не всегда позволяют с достаточной надежностью различать зоны поражения и некоторые нормальные ткани. Так, на Т2-взвешенных изображениях зоны патологических изменений вещества мозга часто имеют высокий сигнал и выглядят как более яркие участки. Аналогичный высокий сигнал имеет также нормальная спинномозговая жидкость, что затрудняет выявление патологических очагов, располагающихся около пространств, заполненных данной жидкостью. Для преодоления данного недостатка разработана методика FLAIR (Fluid Attenuated Inversion Recovery), обеспечивающая подавление сигнала свободной воды (спинномозговой и некоторых других физиологических жидкостей) при сохранении базовой Т2-взвешенности изображения. FLAIR лучше выявляет очаговые изменения мозга.
Нельзя не отметить, что (по нашим данным наблюдения 35 пациентов) оценить наличие и размер перифокального отека при ЭЭГ - исследовании невозможно. Такая же ситуация существует и в гуманной медицине. Изменения биоэлектрической активности мозга (ЭЭГ) при глиальных опухолях неспецифичны и отражают реакцию мозга на поражение, развивающееся в нем. В дооперационном периоде ЭЭГ позволяет получить объективную информацию о функциональном состоянии мозга, выявить наличие и локализацию эпилептического очага у пациентов, имеющих эпилептические припадки (Фадеева Т.Н. 2004). Следует исходить из данных о том, что опухолевая ткань электрически нейтральна, поэтому на ЭЭГ нет отражения места локализации опухоли. Однако при проведении противоотечной терапии (дексаметазон 1мг/кг 2 раза в день) перед оперативным лечением либо при неоперабельных опухолях вместе с регрессом неврологических симптомов очень быстро происходит нормализация электрической активности головного мозга, что, несомненно, указывает на влияние перифокального отека на электрическую активность мозга.
Список литературы:
- Chan Р.Н., Fishmann R.A. Brain edema: induction in cortical slices by polyunsaturated fatty acids //Science. — 1978. — V.201, №5607. — P.358—360.
- Priden F.R., Tsayumu M., Reulen H.J. Measurement of vasogenic brain edema clearance into ventricular CSF //Surg. Forum. — 1979. — V.30, №5. — P. 446—453.
- S.Reulen H.J., Graber S., Huber P., Jto U. Factors off ecting the extension of peritumoral brain oedema ACT-study //Acta Neurochir. — 1988. — V.96, №1—2. — P. 19—24.
- Motta L., Mandara M. T., Skerritt G. C. Canine and feline intracranial meningiomas: an updated review. The Veterinary Journal, 192, 153-165. Source ChesterGates Animal Referral Hospital, Chester Gate Road, Telford Court, Unit E-F, Chester CH16LT, United Kingdom.
- Чувашова О.Ю. Характеристика перифокального отека при глиомах полушарий головного мозга различной степени анаплазии по данным компьютерной и магнитно-резонансной томографии. Институт нейрохирургии им. акад. А.П.Ромоданова АМН Украины, г. Киев. 2000.
- Кобяков Г.Л., Коновалов А.Н., Личиницер М.Р. и др. Современные возможности химиотерапии в лечении злокачественных опухолей // Современные минимально-инвазивные технологии (нейрохирургия, вертебрология, неврология, нейрофизиология): Материалы симпозиума. — СПб., 2001.—С. 251-253.
- Коновалов A.Н., Корниенко В.Н. Компьютерная томография в нейрохирургической клинике. — М.: Медицина, 1985.— С. 20—44.
- Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии. — М.: Видар, 1997.—С. 95-134.
- Yamada K., Soreusen A.G. Diagnostic imaging // Neurooncology. The Essentials. — New York, 2000. — Ch. 6. — P. 56 —77

 Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки). Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка) Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование