Крейг А. Клиффорд, Эндрю Дж. МаккиниКаролинДж. Генри (Craig A. Clifford, Andrew J. Mackin, and Carolyn J. Henry)
Гемангиосаркома (ГАС) – очень злокачественная опухоль из эндотелиальных клеток, встречающаяся у собак чаще, чем у любых других домашних животных, и характеризующаяся очень высокой смертностью.1–4 Сообщается, что ее общая распространенность составляет 0,3-2,0% от всех опухолей у собак.1,2 Средний возраст постановки диагноза �- 9-12 лет.1–4 ГАС встречается у собак почти всех пород, однако к ней предрасположены немецкие овчарки, золотистые ретриверы, лабрадор-ретриверы и шнауцеры.1–4 Доказательств половой предрасположенности нет, хотя многие публикации говорят о большем количестве кобелей среди больных собак.1–4 Этиология ГАС неизвестна, хотя выраженная связь с породой дает основания предполагать наследственную или семейную предрасположенность. У людей выявлена связь воздействия диоксида тория, а также соединений мышьяка или винилхлорида с развитием ГАС.5
ГАС кожи обычно обнаруживается у собак с сильной пигментацией, что может говорить о корреляции с ультрафиолетовым облучением.6 Еще один предполагаемый фактор, способствующий развитию ГАС у собак, – локальное облучение.7
ГАС может развиться в любой ткани организма, однако чаще всего поражаются три органа: селезенка (28-50%), правое предсердие и ушко предсердия (3-50%) и кожа или подкожная клетчатка (13%).1,8–10 К прочим основным органам, поражающимся опухолью, относятся печень, почки, мочевой пузырь, предстательная железа, брюшина, легкие, легочная артерия, аорта, мышцы, кости, ротовая полость, язык, тело позвонка и центральная нервная система.2,10–17 Опухоль метастазирует и прорастает в окружающие ткани на ранней стадии. Чаще всего метастазы развиваются в печени, сальнике и легких.1–4 Метастазирование возможно гематогенным путем, либо после локального распространения клеток в результате разрыва опухоли. Примерно в 25% случаев опухолей селезенки обнаруживаются соответствующие опухоли в сердце (правом предсердии и ушке предсердия).1,2 Сначала полагали, что опухоли сердца метастатические; однако теперь общепризнано, что это две отдельные первичные опухоли.12 Частота метастазирования ГАС кожи обычно ниже; по-видимому, чем глубже расположена опухоль, тем выше вероятность метастаза. У собак с поздней стадией ГАС часто не удается установить место возникновения первичной опухоли.
Эта статья написана с тремя целями: во-первых, представить краткий исторический обзор методов лечения ГАС; во-вторых, исследовать более новые методы лечения; в-третьих, дать представление о нескольких текущих проектах, которые представляются многообещающими для лечения ГАС в будущем.
Традиционная терапия
Исторически методом выбора при ГАС считалось хирургическое лечение, хотя оно почти не увеличивает общее время выживания.4,18,19 По данным трех исследований на собаках с ГАС селезенки, которых лечили только хирургическим способом, медиана времени выживания составила 2-3 месяца.4,18,19 Результаты после хирургического иссечения ГАС сердца также неудовлетворительны, медиана времени выживания варьирует от 3 до 5 месяцев.20–22 Время выживания при кожных ГАС обычно больше.23 Из-за ограничений, присущих хирургическому лечению, со временем основным компонентом терапии стала химиотерапия.11 Описаны различные протоколы, основанные на доксорубицине с добавлением винкристина и циклофосфамида или без, при которых время выживания наибольшее.2,3,24–27 Опубликованные протоколы включают монотерапию доксорубицином (30 мг/м2 внутривенно каждые 3 недели до 5 циклов); доксорубицин и циклофосфамид (доксорубицин как при монотерапии, на 3-6 день каждого 3-недельного цикла добавляется циклофосфамид в дозе 50–75 мг/м2 внутривенно); винкристин, доксорубицин и циклофосфамид (доксорубицин как для монотерапии, в первый день каждого 3-недельного цикла добавляется циклофосфамид в дозе 100 мг/м2 внутривенно, а также винкристин в дозе 0,75 мг/м2 внутривенно на 8 и 15 дни каждого цикла).1–3,24–26 Время выживания, описанное при разных протоколах на основе доксорубицина, варьирует от 140 до 202 дней, хотя ни один из протоколов не обладает явными преимуществами перед другими.3,24–27 Очевидна необходимость в поиске дополнительных или альтернативных методов лечения, которые бы увеличили время выживания собак с ГАС.
Новые системы доставки
Понимание характера метастазирования ГАС способствовало разработке протоколов, направленных на предотвращение метастазов. Многие собаки с ГАС умирают от метастатического поражения легких и органов брюшной полости. Возможно, дополнительная локальная химиотерапия в зонах частого метастазирования сможет задержать развитие метастазов и продлить выживание.28
Стратегия ингаляционной химиотерапии направлена на подавление микрометастазов в легких. Эффективность и безопасность ингаляционной химиотерапии исследовалась на нескольких собаках с ГАС селезенки.28 После спленэктомии собаки получили 4 цикла доксорубицина и циклофосфамида с интервалом 3 недели в дополнение к ингаляционному введению доксорубицина. Ингаляционный доксорубицин представлял собой недавно разработанную форму и вводился через аэрозольное устройство специальной конструкции. После завершения четвертого цикла и раз в 2 месяца в последующем делали рентгеновские снимки и УЗИ брюшной полости. Промежуточный анализ данных дает основания полагать, что этот протокол может быть эффективен и не способствует повышению токсичности при одновременной системной химиотерапии доксорубицином.28
Пространственно стабилизированные липосомы представляют собой липосомы, содержащие небольшую фракцию мембранного гликолипида или другого поверхностного стабилизатора, действующего как внешний стерический барьер.29 Благодаря такой форме снижается захват моноцитарной фагоцитирующей системой, таким образом, воздействие препарата на опухоль продлевается.29 Пэгилированный доксорубицин, инкапсулированный в липосомах,a представляет собой уникальную систему доставки доксорубицина.29 Доксил прошел оценку на собаках с различными злокачественными новообразованиями, включая ГАС и обладает усиленным противоопухолевым действием, меньшей кардиотоксичностью, а также создает устойчивые концентрации в крови по сравнению с доксорубицином.29,30
Брюшная полость – еще одно распространенное место метастатического распространения ГАС.31 Один из методов лечения при метастазах в брюшную полость заключается во введении непосредственно в полость химиотерапевтических препаратов, таких как цисплатин или карбоплатин. Описано внутриполостное введение цисплатина собакам с различными опухолями брюшной полости.32 Эффективность введения карбоплатина в брюшную полость собак с очевидными метастазами ГАС в настоящее время исследуется (Post, личная переписка). Однако диффузия в ткани и проникающая способность карбоплатина меньше, чем у цисплатина, поэтому маловероятно, что карбоплатин будет эффективнее при ГАС.33,34
Иммуномодуляторы
Препараты, изменяющие биологические реакции, могут эффективно применяться для лечения ГАС собак в сочетании с химиотерапией.35,36 Мурамил-трипептид-фосфатидилэтаноламин (МТП-ФЭ) – липофильное производное мурамилдипептида (МДП) - синтетическая молекула, сходная с фрагментом пептидогликана клеточой стенки различных бактерий. И МДП, и МТП-ФЭ способны к неселективному активированию линии макрофагов, заставляя их уничтожать опухолевые клетки, и оба эти вещества можно инкапсулировать в липосомы для оптимизации доставки.
МТП-ФЭ (Л-МТП-ФЭ), инкапсулированные в липосомах, при применении в сочетании с химиотерапией увеличивают безрецидивный интервал и время выживания собак с остеосаркомой.35 Кроме того, оценивалась эффективность Л-МТП-ФЭ в сочетании с химиотерапией у собак с ГАС.35 В одном исследовании 32 собак с ГАС селезенки разделили на две группы лечения.35 Одной группе вводили доксорубицин и циклофосфамид (АС) раз в 3 недели 4 курсами, а также Л-МТП-ФЭ дважды в неделю в течение 8 недель. Контрольная группа получала АС и плацебо (пустые липосомы). Медиана времени выживания в группе, получавшей АС в сочетании с Л-МТП-ФЭ, составила 277 дней, что было значительно лучше, чем в группе, получавшей только АС (143 дня). Кроме того, время выживания при применении АС и Л-МТП-ФЭ в сочетании было выше в сравнении с ранее опубликованными данными при применении винкристина, доксорубицина и циклофосфамида (187 дней) или АС (178 дней).24,25 Число опубликованных дополнительных исследований Л-МТП-ФЭ у собак с ГАС мало. Вероятно, что недостаточный интерес к исследованиям Л-МТП-ФЭ в настоящее время связан с ограниченной доступностью специфической липосомной системы в ветеринарии и высокой стоимостью продукта. Возможно, что в следующие несколько лет станут доступны менее дорогостоящие липосомные системы доставки.
Противометастатические препараты
Метастатический «каскад» - ступенчатый процесс, в ходе которого опухолевые клетки растут и распространяются в другие органы (рис. 1). Вкратце: стадии этого каскада включают трансформацию, ангиогенез, подвижность и прорастание в окружающие ткани, эмболию и проникновение в циркулирующую кровь, скопление в капиллярном русле, прикрепление к стенкам капилляров, выход из сосудов в паренхиму органов, приспособление к локальной среде, пролиферацию опухолевых клеток и дальнейший ангиогенез. Понимание процессов, участвующих в метастазировании, позволяет создать и применять препараты, направленные на контроль конкретных стадий метастатического каскада.
В следующих разделах обсуждается несколько препаратов, способных изменить процесс метастазирования за счет влияния на ангиогенез (интерферон, талидомид), предотвращения расщепления матрикса (ингибирование матриксных металлопротеиназ, миноциклин), а также изменения рациона. Многие из обсуждающихся ниже препаратов находились или находятся в процессе исследования в качестве средств для лечения ГАС у собак.
Подавление ангиогенеза
Ангиогенезом называют формирование новых сосудов из существующих микрососудов - это необходимый компонент метастазирования, обеспечивающий основной путь, по которому опухолевые клетки покидают место первичной опухоли и проникают в циркулирующую кровь.37 Предполагают, что опухоли могут существовать неограниченный период времени без формирования новых сосудов до тех пор, пока не «переключатся» на ангиогенный фенотип.38 Опухоли могут индуцировать ангиогенез за счет изменения локальной среды путем избыточной экспрессии ангиогенных факторов, привлечения локальных клеток и индукции высвобождения ими ангиогенных факторов, мобилизации ангиогенных белков из внеклеточного матрикса или снижения высвобождения антиагниогенных тканевых факторов.38 И наоборот, опухоли могут подавлять ангиогенез, активируя ингибиторы ангиогенеза, подавляющие формирование новых сосудов в месте как первичной опухоли, так и метастазов. Устранение ингибиторов ангиогенеза может объяснить пролиферацию метастазов в легких, иногда наблюдающуюся после удаления первичной опухоли у собак с остеосаркомой и ГАС.
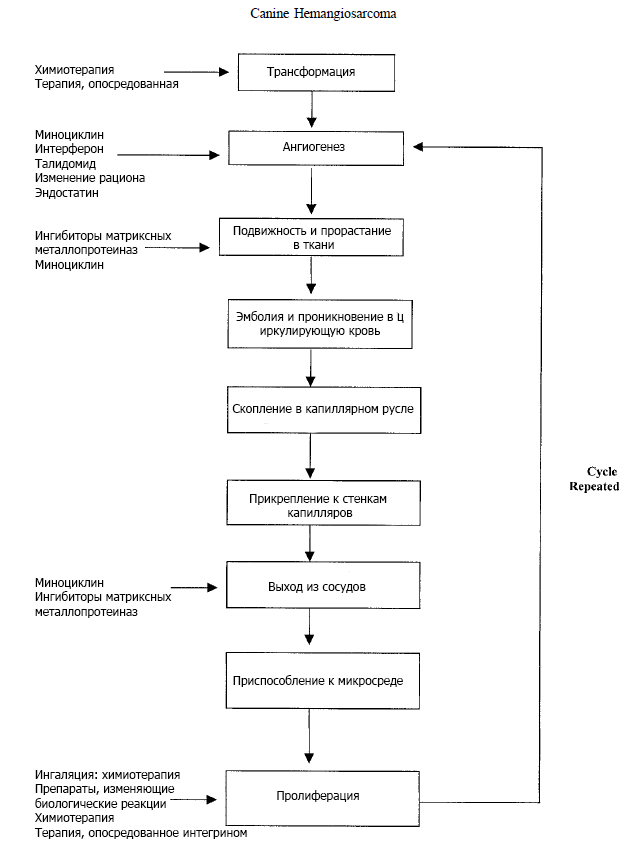
Рис. 1. Стадии метастатического каскада. Слева перечислены препараты, специфически воздействующие на каждую из соответствующих стадий.
Известно не менее 15 белков, активирующих рост и подвижность эндотелиальных клеток, в том числе фактор роста фибробластов, фактор роста эндотелия сосудов, ангиогенин, трансформирующие факторы роста, фактор некроза опухолей-альфа, эпидермальный фактор роста, тромбоцитарный фактор роста эндотелиальных клеток, плацентарный фактор роста, интерлейкин-8, стимулирующий гранулоцитарный фактор и пролиферин.38Фактор роста сосудистого эндотелия и основной фактор роста фибробластов экспрессируются многими опухолями и действуют непосредственно на эндотелиальные клетки, в то время как трансформирующий фактор роста и тромбоцитарный фактор роста привлекают и активируют воспалительные клетки или клетки соединительной ткани, в свою очередь, контролирующие ангиогенез.
В целом, при создании антиангиогенных препаратов используется 4 основные стратегии: блокада факторов, стимулирующих формирование новых сосудов, использование естественных ингибиторов ангиогенеза, блокада молекул, позволяющих новообразованным сосудам прорастать в окружающие ткани и подавление активности новых делящихся эндотелиальных клеток. Некоторые из известных ингибиторов ангиогенеза включают ангиотензин, эндостатин, ангиостатические стероиды, интерфероны, интерлейкин-12, ретиноевую кислоту и тканевый ингибитор матриксных металлопротеиназ 1 и 2.38–40Ангибиторы ангиогенеза не вызывают нежелательных явлений, таких как подавление активности костного мозга и желудочно-кишечные симптомы, часто возникающие при применении химиотерапевтических препаратов; а также, по-видимому, не индуцируют лекарственную полирезистентность.41В настоящее время около 20 ингибиторов ангиогенеза исследуются в ходе клинических испытаний I и II фазы, а исследования трех достигли IIIфазы.38,39,42
Интерфероны (альфа и бета) – одни из наиболее известных ингибиторов ангиогенеза в медицине, эффективные для лечения гемангиом у детей.43–46Лечение интерфероном может индуцировать полный регресс гемангиомы, ранее не отвечавшей на другие виды терапии.47Итерферон альфа-2а, по-видимому, подавляет ангиогенез за счет подавления основного фактора роста фибробластов и выработки фактора роста сосудистого эндотелия. Основной фактор роста фибробластов – один из белков с избыточной экспрессией в гемангиомах у детей, в то время как концентрация фактора роста эндотелия сосудов в сыворотке повышается у людей с другим сосудистым новообразованием - ангиосаркомой.38,48Концентрация основного фактора роста фибробластов в моче повышается при переходноклеточном раке у собак, однако у собак с ГАС это пока не описано.49
Интерферон-альфа имеется в продаже и исследуется в ходе клинических испытаний III фазы при ряде злокачественных новообразований людей.39,42В настоящее время проводится несколько ветеринарных клинических исследований для оценки интерферона альфа-2bв сочетании со стандартной химиотерапией (АС, доксорубицин), а также другим антиангиогенным препаратом – талидомидом (VailandPost, личная переписка). Основным потенциальным недостатком применения интерферона для собак является дороговизна и сложность выполнения ежедневных инъекций для владельцев. В конечном итоге могут выработаться нейтрализующие антитела к интерферону, что ограничивает эффективность и заставляет увеличивать дозу; однако это еще предстоит доказать. В медицине вопрос о том, могут ли антитела к интерфеону значительно повлиять на эффективность терапии, по-прежнему обсуждается.50,51
Талидомид- известный тератогенный препарат, представляет собой ингибитор ангиогенеза.52Вероятно, что талидомид подавляет фактор роста эндотелия сосудов, основной фактор роста фибробластов и фактор некроза опухолей альфа, а также может стать привлекательной альтернативой для лечения злокачественных опухолей благодаря своей способности подавлять ангиогенез и предотвращать кахексию, связанную с фактором некроза опухоли альфа.52–54Подавление фактора некроза опухолей альфа, по-видимому, зависит от дозы, и для терапевтического эффекта могут потребоваться высокие дозы талидомида.52Одним из потенциальных преимуществ талидомида является редкость нежелательных явлений у нещенных сук.55Талидомид проходит клинические испытанияIIфазы как средство лечения ряда злокачественных новообразований у людей.39,54,56–58В настоящее время проводится ветеринарное клиническое испытание I и II фазы для оценки талидомида как препарата для монотерапии различных злокачественных новообразований у собак, и на данный момент его переносимость представляется хорошей.55Также талидомид оценивается в нескольких ветеринарных клинических исследованиях на собаках с ГАС, отдельно или в сочетании со стандартной химиотерапией, доксорубицином (Khanna, Post, Matthews, andMeleo, личная переписка).
Одним из возможных недостатков талидомида, как и остальных ингибиторов ангиогенеза, является длительное время проявления очевидных полезных эффектов. Так как теоретически ингибиторы ангиогенеза нарушают только развитие новых сосудов, возможно, что такие препараты почти или совсем не влияют на уже существующую опухолевую ткань. Таким образом, хотя ингибиторы ангиогенеза могут предотвратить метастазирование опухоли, для уменьшения размера уже существующих опухолей необходимы дополнительные меры.
Ингибиторы матриксных металлопротеиназ
Матриксные металлопротиназы – семейство, включающее не менее 26 цинк-зависимых эндопептидаз, связанных с мембраной.41,59–64
Эти ферменты способны расщеплять многие компоненты внеклеточного матрикса, в том числе фибриллярные и нефибриллярные коллагены, фибронектин, ламинин и гликопротеиды базальной мембраны.39,59,63–65Матриксные металлопротеиназы играют большую роль в нормальных физиологических состояниях, таких как заживление ран, беременность и другие процессы, связанные с перестройкой тканей.59,60,65Кроме того, существуют тканевые ингибиторы матриксных металлопротеиназ, поддерживающие баланс между разрушением и формированием внеклеточного вещества. У многих здоровых животных существует хрупкое равновесие между делением клеток, формированием внеклеточного вещества и его разрушением.
Внеклеточное вещество составляет основной барьер для опухолевого роста и метастатической способности.66Иногда злокачественные опухоли используют матриксные металлопротеиназы для преодоления этого внеклеточного барьера.59,66Матриксные металлопротеиназы участвуют не только в стимуляции прорастания опухоли в кровеносные или лимфатические сосуды, но также и в регулировке пролиферации в месте первичной и вторичной опухоли и создании и поддержании локальной среды, позволяющей опухоли расти.60,63,65,66У людей с раковыми опухолями описано повышение активности матриксных металлопротеиназ, что было связано с плохой выживаемостью некоторых пациентов.59,60,63,66Сообщается, что у собак с новообразованиями активность матриксных металлопротеиназ выше, чем у здоровых.62Большинство матриксных металлопротеиназ синтезируется стромальными клетками, а не опухолевыми, что говорит о возможном взаимодействии между опухолевыми клетками и клетками из непосредственного окружения.59,66Рецепторы матриксных металлопротеиназ присутствуют на стромальных клетках и, таким образом, должны быть также на опухолевых клетках, чтобы сделать возможным связывание и активацию матриксных металлопротеиназ.59,66При злокачественных новообразованиях может существовать дисбаланс между матриксными металлопротеиназами и их тканевыми ингибиторами. Естественные тканевые ингибиторы матриксных металлопротеиназ подавляли индуцированный опухолью ангиогенез в экспериментальных системах.59,64Из-за короткого времени полувыведенияinvivo естественные тканевые ингибиторы матриксных металлопротеиназ не подходят для клинических исследований. Поэтому были разработаны синтетические ингибиторы матриксных металлопротеиназ с активностью, усиленной фармакологическими методами; к примерам относятся Маримастат, Bay 12–9566, AG3340, CGS27023A, COL-3 иBMS-275291.40В экспериментальных исследованиях ингибиторы матриксных металлопротеиназ замедляли рост первичных опухолей, локальное распространение и метастазирование в отдаленные органы.63При применении этих веществ в сочетании с цитотоксическими препаратами их эффекты суммировались. Медицинские клинические испытания нескольких синтетических матриксных металлопротеиназ для лечения рака легкого, молочной железы, яичника, поджелудочной железы и предстательной железы достигли IIIфазы.63–67
В ветеринарии взаимоотношения между матриксными металлопротеиназами и опухолями поняты не до конца. Исследования направлены на идентификацию матриксных металлопротеиназ и определение их связи с различными злокачественными опухолями.62,65,68–71Возможно, что применение результатов таких исследований в клинике приведет к разработке специфических ингибиторов матриксных металлопротеиназ для адъювантной терапии. В настоящее время проводятся предварительные исследования ингибиторов матриксных металлопротеиназ для лечения ряда злокачественных новообразований (Ogilvie, личная переписка).
Производные тетрациклина
Миноциклин, полусинтетическое производное тетрациклина, обладающее как антиогенными свойствами, так и активностью ингибитора матриксных металлопротеиназ, стал основным предметом нескольких исследований в медицинской онкологии. По-видимому, миноциклин локально ингибирует активность коллагеназы, препятствуя ангиогенезу. Неизвестно, обусловлен ли этот механизм ингибированием матриксных металлопротеиназ, либо независимым от металлопротеиназ процессом.72Миноциклин показал свою эффективность в исследованиях внутричерепной глиомы у людей, а также рака из островковых клеток и рака легких Льюиса у лабораторных животных.73–75Одно из исследований, в котором собакам с ГАС проводили только химиотерапию (протокол АС) или химиотерапию в сочетании с миноциклином, не показало значительных различий времени выживания.76Однако возможно, что миноциклин даст благоприятный эффект при менее продвинутой стадии заболевания.76
Изменения рациона
В последнее время значительное внимание стали уделять вопросам питания животных с раковыми заболеваниями.77–84 Новообразования сопровождаются множеством метаболических нарушений. Для описания таких нарушений используют термин «паранеопластический синдром», то есть раковая кахексия, характеризующаяся потерей веса несмотря на достаточное питание. У раковых пациентов страдают все виды обмена - углеводный, липидный и белковый.
В связи с клинической значимостью метаболических нарушений, связанных со злокачественными опухолями, стали предприниматься попытки коррекции рациона с целью уменьшения кахексии. Некоторым онкологическим пациентам может быть полезна диета с низким содержанием простых углеводов и умеренным количеством белка высокой биодоступности, с добавкой омега-3 жирных кислот и специфических аминокислот, таких как аргинин, глицин, глутамин и цистеин.77Одним из ключевых компонентов диетотерапии рака является использование источника жира в качестве главной энергетической составляющей рациона, с вниманием к типу и соотношению жирных кислот в рационе.77,84Диеты высокой жирности могут оказывать благоприятное действие на раковых пациентов двумя путями.77,78,80,84 Во-первых, жиры, по-видимому, не являются эффективным источником энергии для опухоли, поэтому рацион, богатый жировыми калориями, заставляет опухолевые клетки «голодать», в отличие от нормальных клеток организма.77,80,84Во-вторых, показано, что омега-3 жирные кислоты обладают особенными антиангиогенными свойствами и подавляют развитие опухолей в экспериментах на животных.78Эйкозапентаноевая кислота, омега-3 жирная кислота, способна убивать опухолевые клетки, как показали эксперименты на животных, не повреждая нормальные клетки.78В недавнем двойном слепом рандомизированном исследовании оценивали влияние специализированного рациона, богатого полиненасыщенными омега-3 жирными кислотами и аргинином, на параметры метаболизма, химические показатели воспаления, качество жизни, а также безрецидивные интервалы и время выживания собак с лимфомой.77У животных, получавших специальную диету, отмечено снижение концентрации молочной кислоты, а безрецидивный интервал и время выживания у них были значительно выше, чем у контрольных животных.79С тех пор был разработан аналогичный коммерческий корм, способствующий увеличению времени выживания и качества жизни собак с онкологическими заболеваниями (Hill’sNeoplasiaDiet [ND]).bХотя кормNDразработан для собак с лимфомой, по-видимому, его оправданно применять и при других опухолях.85 Так как у животных с ГАС развивается кахексия, логично заключить, что диетотерапия - целесообразный метод лечения. В настоящее время проводится ветеринарное исследование для оценки эффекта диеты у собак с ГАС (Ogilvie, личная переписка).
После 2000 г
Прочие интересные и многообещающие методы терапии ГАС у собак включают введение антител против конкретных антигенов или рецепторов на поверхности опухолевых клеток и разработку рекомбинантных ингибиторов ангиогенеза. Интегрины – молекулы адгезии, опосредующие взаимодействия клеток с межклеточным веществом и между собой.86,87Они важны для нескольких биологических процессов, включая дифференциацию клеток, злокачественную трансформацию, иммунные функции и свертывание крови.86,87Интегрины экспрессируются на поверхности многих клеток, включая остеобласты и эндотелиальные клетки.86,87Интегрины обнаружены у собак с остеосаркомой, и в настоящее время проводятся исследования для определения степени экспрессии интегринов у собак с ГАС.87Семейства интегринов могут стать интересной мишенью для антител, химиотерапевтических препаратов или ингибиторов клеточного роста.
Еще один возможный путь – применение рекомбинантных ингибиторов ангиогенеза для предотвращения метастазов и роста опухоли. В настоящее время разрабатывается собачий рекомбинантный эндостатин - естественный ингибитор ангиогенеза, клинические исследования которого могут начаться в ближайшем будущем (Khanna, личная переписка).
Заключение
ГАС – агрессивное и злокачественное новообразование с безнадежным прогнозом. Хирургическое лечение и химиотерапия улучшают время выживания и качество жизни собак с ГАС лишь в ограниченной степени. Однако недавние достижения в области ухода и лечения помогают увеличить время выживания и качество жизни больных собак. Возможно, что разработка новых методов анализа, позволяющих обнаружить ГАС на ранней стадии, позволит начать лечение прежде, чем разовьются очевидные клинические симптомы или макроскопические признаки болезни.76Определение новых молекулярных механизмов, участвующих в метастатическом каскаде, открыло путь к разработке уникальных методов лечения, использующих различные биологические пути. В особенности многочисленные клинические исследования сосредоточены на подавлении ангиогенеза. Подавление ангиогенеза представляется безопасным методом и, в отличие от химиотерапии, не индуцирует лекарственную резистентность. Хотя многие из обсуждающихся средств по-прежнему находятся в процессе разработки и рассмотрения, очевидно, что применение комбинированного подхода, включающего инновационные методы лечения, может дать наилучшие возможности лечения собак с ГАС.
Сноски
a Doxil, Sequus Pharmaceuticals Inc, Menlo Park, CA
b Hill’s Neoplasia Diet, Hill’s Pet Nutrition, Topeka, KS
Литература:
1. Hosgood G. Canine hemangiosarcoma. Compend Cont Educ Pract Vet 1991;13:1065–1075.
2. Hammer AS, Couto CG. Diagnosing and treating canine hemangiosarcoma. Vet Med 1992;87:188–201.
3. Ogilvie GK, Moore AS. Hemangiosarcoma. In: Ogilvie GK, Moore AS, eds. Managing the Veterinary Cancer Patient; A Practice Manual. Trenton, NJ: Veterinary Learning Systems; 1995:367–376.
4. Brown NO, Patnaik AK, MacEwen EG. Canine hemangiosarcoma: Retrospective analysis of 104 cases. J Am Vet Med Assoc 1985; 186:56–58
5. Adam YG, Huvos AG, Hajdu SI. Malignant vascular tumors in the liver. Ann Surg 1972;175:375–383.
6. Withrow SJ, MacEwen EG. Hemangiosarcoma. In: Withrow SJ, MacEwen EG, eds. Small Animal Clinical Oncology. Philadelphia, PA: WB Saunders; 1996:521–528.
7. Rebar A, Han FF, Halliwell WH, et al. Microangiopathic hemolytic anemia associated with radiation induced hemangiosarcoma. Vet Pathol 1980;17:443–45.
8. Aronsohn M. Cardiac hemangiosarcoma in the dog: A review of 38 cases. J Am Vet Med Assoc 1985;187:922–926.
9. Wykes PM, Rouse GP, Orton EC. Removal of five canine cardiac tumors using a stapling instrument. Vet Surg 1986;15:103–106.
10. Ward H, Fox LE, Calderwood-Mays MB, et al. Cutaneous hemangiosarcoma in 25 dogs; a retrospective study. J Vet Intern Med 1994;8:345–348.
11. Parchman MB, Crameri FM. Primary vertebral hemangiosarcoma in a dog. J Am Vet Med Assoc 1989;194:79–81.
12. Morrison WB. Blood vascular, lymphatic and splenic cancer. In: Morrison WB, ed. Cancer in Dogs and Cats: Medical and Surgical Management. Baltimore, MD: Williams and Wilkins; 1998:705–715.
13. Waters DJ, Hayden DW, Walter PA. Intracranial lesions in dogs with hemangiosarcoma. J Vet Intern Med 1989;3:222–230.
14. Srebernik N, Appleby EC. Breed prevalence and sites of haemangioma and haemangiosarcoma in dogs. Vet Rec 1991;129:408–409.
15. Pharr JW, Holmberg DL, Clark EG. Hemangiosarcoma in the main pulmonary artery of a dog. Vet Radiol Ultrasound 1992;33:78– 82.
16. Ohler C, Mughannam A, Reinke JD, et al. Transient hemi-inattention in a dog with metastatic renal hemangiosarcoma. J Am Anim Hosp Assoc 1994;30:207–212.
17. Crow SE, Bell TG, Wortman JA. Hematuria associated with renal hemangiosarcoma in a dog. J Am Vet Med Assoc 1980;176:531– 533.
18. Johnson KA, Powers BE, Withrow SJ, et al. Splenomegaly in dogs; predictors of neoplasia and survival after splenectomy. J Vet Intern Med 1989;3:160–166.
19. Wood CA, Moore AS, Gliatto JM, et al. Prognosis for dogs with stage I or II splenic hemangiosarcoma treated by splenectomy
alone: 32 cases (1991–1993). J Am Anim Hosp Assoc 1998;34:417– 421.
20. Berg J. Pericardial disease and cardiac neoplasia. Semin Vet Med Surg 1994; 9:185–191.
21. Dunning D, Monnet E, Orton EC, et al. Analysis of prognostic indicators for dogs with pericardial effusion: 46 cases (1985–1996). J Am Vet Med Assoc 1998;212:1276–1280.
22. Kerstetter KK, Krahwinkel DJ, Mills DL, et al. Pericardectomy in dogs: 22 cases (1978–1994). J Am Vet Med Assoc 1997;211:736– 740.
23. Hargis AM, Ihrke PJ, Spangler WL, et al. A retrospective clinicopathologic study of 212 dogs with cutaneous hemangioma and hemangiosarcoma. Vet Pathol 1992;29:316–328.
24. Hammer AS, Couto CG, Filppi J, et al. Efficacy and toxicity of VAC chemotherapy (vincristine, doxorubicin, and cyclophosphamide) in dogs with hemangiosarcoma. J Vet Intern Med 1991;5:160–166.
25. Sorenmo KA, Jeglum KA, Helfand SC. Chemotherapy of canine hemangiosarcoma with doxorubicin and cyclophosphamide. J Vet Intern Med 1993;7:370–376.
26. Ogilvie GK, Powers BE, Mallinckrodt CH, et al. Surgery and doxorubicin in dogs with hemangiosarcoma. J Vet Intern Med 1996; 10:379–384.
27. de Madron E, Helfand SC, Stebbins KE. Use of chemotherapy for treatment of cardiac hemangiosarcoma in a dog. J Am Vet Med Assoc 1987;190:887–891.
28. Vail DM, Hershey AE, Kurzman ID, et al. Inhalation chemotherapy as an adjuvant therapy in the micrometastasis setting: Proof of principle. Veterinary Cancer Society 18th Annual Meeting, Estes Park, CO, 1998.
29. Vail DM. Liposomal encapsulation in veterinary oncology. American College of Veterinary Internal Medicine 17th Annual Veterinary Medical Forum, Chicago, IL, 1999.
30. Vail DM, Kravis LD, Cooley AJ, et al. Preclinical trial of doxorubicin entrapped in sterically stabilized liposomes in dogs with spontaneously arising malignant tumors. Cancer Chemother Pharmacol 1997;39:410–416.
31. Waters DJ, Caywood DD, Hayden DW, et al. Metastatic pattern in a dog with splenic hemangiosarcoma: Clinical implications. J Small Anim Pract 1988;19:805–814.
32. Moore AS, Kirk C, Cardona A. Intracavitary cisplatin chemotherapy with six dogs. J Vet Intern Med 1991;5:227–231.
33. Chun R, Knapp DW, Widmer WR, et al. Phase II clinical trial of carboplatin in canine transitional cell carcinoma of the urinary bladder. J Vet Intern Med 1997;11:279–283.
34. O’Dwyer PJ, Johnson SW, Hamilton TC. Cisplatin and its analogues. In: DeVita VT Jr, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology, 5th ed. Philadelphia, PA: Lippincott-Raven; 1997:418–432.
35. Vail DM, MacEwen EG, Kurzman ID, et al. Liposome-encapsulated muramyl tripeptide phosphatidylethanolamine adjuvant immunotherapy for splenic hemangiosarcoma in the dog: A randomized multi-institutional clinical trial. Clin Cancer Res 1995;1:1165–1170.
36. MacEwen EG, Kurzman ID, Rosenthal RC, et al. Therapy for osteosarcoma in dogs with intravenous injection of liposome-encapsulated muramyl tripeptide. J Natl Cancer Inst 1989;81:935–938.
37. Fedler IJ. Molecular biology of cancer: Invasion and metastasis. In: Devita VT Jr, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology, 5th ed. Philadelphia, PA: Lippincott-Raven; 1997:135–152.
38. Folkman J. Clinical applications of research on angiogenesis. Seminars in Medicine of the Beth Israel Hospital, Boston, MA. 1995; 333:1757–1763.
39. Ogilvie GK. Clinical inhibitors of metalloproteinases and angiogenesis. American College of Veterinary Internal Medicine 17th Annual Veterinary Medical Forum, Chicago, IL, 1999.
40. Angiogenesis inhibitors in clinical trials. National Cancer Insti
CanineHemangiosarcoma485
jvim 14 501 Mp 485 File # 01em
tute cancerTrials Web site. Available at: http://cancertrials.nci.nih.gov/ news/angio/table.html. Accessed September 20, 1999.
41. Boehm T, Folkman J, Browder T, et al. Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance. Nature 1997;390:404–407
42. Nelson NJ. Inhibitors of angiogenesis enter phase III testing. J Natl Cancer Inst 1998;90:960–963.
43. White CW. Treatment of hemangiomatosis with recombinant interferon alfa. Semin Hematol 1990;27:15–22.
44. Greinwald JH, Burke DK, Bonthius DJ, et al. An update on the treatment of hemangiomas in children with interferon alfa-2a. Arch Otolaryngol Head Neck Surg 1999;125:21–27.
45. Tamayo L, Ortiz DM, Orozco-Covarrubias L, et al. Therapeutic efficacy of interferon alfa-2b in infants with life-threatening giant hemangiomas. Arch Dermatol 1997;133:1567–1571.
46. Chang E, Boyd A, Nelson CC, et al. Successful treatment of infantile hemangiomas with interferon-alpha-2b. J Pediatr Hematol Oncol 1997;19:237–244.
47. Folkman J. Tumor angiogenesis and tissue factor. Nat Med 1996;2:167–168
48. Fujimoto M, Kiyosawa T, Murata S, et al. Vascular endothelial growth factor in human angiosarcoma. Anticancer Res 1998;18:3725– 3730.
49. Allen DK, Waters DJ, Knapp DW, et al. High urine concentrations of basic fibroblast growth factor in dogs with bladder cancer. J Vet Intern Med 1996;10:231–234.
50. Oberg K, Alm G. The incidence and clinical significance of antibodies to interferon-a in patients with solid tumors. Biotherapy 1997;10:1–5.
51. McKenna RM, Oberg KE. Antibodies to interferon-alpha in treated cancer patients: Incidence and significance. J Interferon Cytokine Res 1997;17:141–143.
52. Rebuck JA, Fish DN. Thalidomide revisited. AIDS Reader 1998;8:7–9.
53. Kruse FE, Joussen AM, Rohrschneider K, et al. Thalidomide inhibits corneal angiogenesis induced by vascular endothelial growth factor. Graefes Arch Clin Exp Ophthalmol 1998;236:461–466.
54. Minchinton AI, Fryer KH, Wendt KR, et al. The effect of thalidomide on experimental tumors and metastases. Anticancer Drugs 1996;7:339–343.
55. Jankowski M, Fulton L, Sheafor S, et al. Ongoing evaluation of single agent thalidomide in dogs with measurable cancer. Veterinary Cancer Society 19th Annual Meeting, Wood’s Hole, MA, 1999. 56. Joseph IB, Isaacs JT. Macrophage role in the anti-prostate cancer response to one class of antiangiogenic agents. J Natl Cancer Inst 1998;90:1648–1653
57. Yarchoan R. Therapy for Kaposi’s sarcoma: Recent advances and experimental approaches. J Acquir Immune Defic Syndr 1999;21: S66–S73.
58. Burton E, Prados M. New chemotherapy options for the treatment of malignant gliomas. Curr Opin Oncol 1999;11:157–161.
59. Curran S, Murray GI. Matrix metalloproteinases in tumour invasion and metastasis. J Pathol 1999;189:300–308.
60. Yu AE, Hewitt RE, Connor EW, et al. Matrix metalloproteinases. Novel targets for directed cancer therapy. Drugs Aging 1997;11: 229–244.
61. Jones JL, Walker RA. Control of metalloproteinase activity in cancer. J Pathol 1997;183:377–379.
62. Lana SE, Hansen RA, Sanderson KR, et al. Matrix metalloproteinases in serum and plasma of normal and tumor bearing dogs. Veterinary Cancer Society 18th Annual Meeting, Estes Park, CO, 1998.
63. Cockett MI, Murphy G, Birch ML, et al. Matrix metalloproteinases and metastatic cancer. Biochem Soc Symp 1998;63:295–313.
64. Wojtowicz-Praga SM, Dickson RB, Hawkins MJ. Matrix metalloproteinase inhibitors. Invest New Drugs 1997;15:61–75.
65. Denis LJ, Verweij J. Matrix metalloproteinase inhibitors: Present achievements and future prospects. Invest New Drugs 1997;15: 175–185.
66. Jones JL, Walker RA. Control of matrix metalloproteinase activity in cancer. J Pathol 1997;183:377–379.
67. Drummond AH, Beckett P, Brown PD, et al. Preclinical and clinical studies of MMP inhibitors in cancer. Ann N Y Acad Sci 1999; 878:228–235.
68. Leibman N, Lana SE, Hansen RA, et al. Identification of matrix metalloproteinases in canine mast cell tumors. Veterinary Cancer Society 18th Annual Meeting, Estes Park, CO, 1998.
69. Bahl T, Lehmann H, Rudolph R. Matrix metalloproteinases: A useful prognostic indicator in canine mammary cancer? Veterinary Cancer Society 18th Annual Meeting, Estes Park, CO, 1998.
70. Lana SE, Ogilvie GK, Hansen RA, et al. Matrix metalloproteinsases levels as a predictor of early treatment failure in dogs with lymphoma. Veterinary Cancer Society 19th Annual Meeting, Wood’s Hole, MA, 1999.
71. Paria BC, Kitchell BE, Bamn RG, et al. Molecular cloning and expression of MMP-9 from canine fibrosarcoma. Veterinary Cancer Society 19th Annual Meeting, Wood’s Hole, MA, 1999.
72. Gilbertson-Beadling S, Powers EA, Stamp-Cole M, et al. The tetracycline analogs minocycline and doxycycline inhibit angiogenesis in vitro by a non-metalloproteinase-dependent mechanism. Cancer Chemother Pharmacol 1995;36:418–424.
73. Teicher BA, Sotomayor EA, Huang ZD. Antiangiogenic agents potentiate cytotoxic cancer therapies against primary and metastatic disease. Cancer Res 1992;52:6702–6704.
74. Weingart JD, Sipos EP, Brem H. The role of minocycline in the treatment of intracranial 9L glioma. J Neurosurg 1995;82:635–640.
75. Parangi S, O’Reilly M, Christofori G, et al. Antiangiogenic therapy of transgenic mice impairs de novo tumor growth. Proc Natl Acad Sci USA 1996;93:2002–2007.
76. Soremno KA, Duda L, Barber L, et al. Treatment of canine hemangiosarcoma with conventional chemotherapy and an antiangiogenic agent. Veterinary Cancer Society 16th Annual Meeting, Pacific Grove, CA, 1996.
77. Ogilvie GK. Interventional nutrition for the cancer patient. Clin Tech Small Anim Pract 1998;13:224–231.
78. Ogilvie GK, Moore AS. Nutritional support. In: Ogilvie GK, Moore AS, eds. Managing the Veterinary Cancer Patient: A Practice Manual. Trenton, NJ: Veterinary Learning Systems; 1995:124–127.
79. Ogilvie GK, Walters LM, Salman MD, et al. Treatment of dogs with lymphoma with Adriamycin and a diet high in carbohydrate or high in fat. Am J Vet Res 1994;8:95–104.
80. Ogilvie GK, Vail DM. Nutrition and cancer: Recent developments. Vet Clin North Am Small Anim Pract 1990;20:969–985.
81. Kern KA, Norton JA. Cancer cachexia. J Parenter Enter Nutr 1988;12:286–298.
82. Heber D, Byerley LO, Chi J, et al. Pathophysiology of malnutrition in the adult cancer patient. Cancer 1986;58:1867–1873.
83. Vail DM, Ogilvie GK, Wheeler SL, et al. Alterations in carbohydrate metabolism in canine lymphoma. J Vet Intern Med 1990;4: 8–11.
84. Howard J, Senior DF. Cachexia and nutritional issues in animals with cancer. J Am Vet Med Assoc 1999;214:632–637.
85. Ogilvie GK. Antimetastasis therapy: The future is now. American College of Veterinary Internal Medicine 16th Annual Veterinary Medicine Forum, San Diego, CA, 1998.
86. Hahn KA. Integrins: The next tumor target? American College of Veterinary Internal Medicine 17th Annual Veterinary Medicine Forum, Chicago, IL, 1999.
87. Hahn KA, Daniel GB. Molecular strategies for targeted tumor imaging. Vet Cancer Soc Newsl 1999;23:1, 4–5.

