Авторы: AdriaanM. Kitshof1 BartVanGoethem1 LudoStegen1 PeterVandekerckhove2 HildedeRooster1
Организации: 1Факультет ветеринарии мелких животных и клинической биологии, Гентский Университет, Гент, Бельгия; 2Ветеринарный центр Malpertuus, Хейсден, Гент, Бельгия
Переписка: AdriaanKitshof
Email: adriaan.kitshof@ugent.be
Почтовый адрес: 133 SalisburyAvenue, Merelbeke, Ghent 9820, Belgium
Даты: получено: 24 июля 2012 г; принято: 18 дек. 2012 г; опубликовано: 05 апр. 2013 г.
Как цитировать эту статью:
Kitshof, A.M., Van Goethem, B., Stegen, L., Vandekerckhove, P. & De Rooster, H., 2013, ‘Laryngeal paralysis in dogs: An update on recent knowledge’, Journal of the South African Veterinary Associaton 84(1), Art. #909, 9 pages. htp://dx.doi.org/10.4102/ jsava.v84i1.909
Паралич гортани развивается в результате неспособности черпаловидного хряща к отведению при вдохе, что приводит к респираторным симптомам, характерным для частичной обструкции дыхательных путей. По этиологии заболевание делят на врожденное (наследственный паралич гортани или наследственная полиневропатия) или приобретенное (травма, новообразования, полиневропатия, эндокринопатия). Наиболее распространенная форма приобретенного паралича гортани (ПГ) встречается у старых собак крупных пород и клинически проявляется генерализованной периферической полиневропатией, недавно получившей название «старческая полиневропатия с параличом гортани». Диагностика ПГ на основании клинических признаков, породы и анамнеза характеризуется высокой чувствительностью (90%), а подтвердить диагноз можно на основании осмотра гортани. Прогноз после хирургической коррекции зависит от этиологии: в травматических случаях прогноз хороший, в то время как при ПГ, индуцированным опухолью или полиневропатией – осторожный. Приобретенный идиопатический ПГ – медленно прогрессирующее заболевание, медиана времени выживания собак после хирургической коррекции составляет 3-5 лет.
Введение
По мнению авторов, частота паралича гортани (ПГ) выше, чем обычно полагают. Это связано главным образом с неправильной диагностикой из-за неспособности распознать типичные клинические признаки. Опыт авторов показывает, что во многих правильно диагностированных случаях дается несоответствующий и чрезмерно неблагоприятный прогноз. Новые данные об идиопатическим ПГ улучшают понимание прогрессирования болезни и ответа на терапию (Stanley et al. 2010). Адаптация хирургических техник и односторонняя латерализация черпаловидного хряща резко уменьшают связанные осложнения (MacPhail & Monnet 2001; White 1989).
Цель этой статьи – ознакомить читателя с клиническими признаками и возможностями лечения ПГ. Также обсуждаются самые распространенные осложнения.
Анатомия
Гортань представляет собой полужесткий орган, состоящий главным образом из гиалинового хряща и мышц (Evans 1993). При вдохе сокращение дорсальной перстнечерпаловидной (ДПЧ) мышцы приводит к отведению черпаловидных хрящей и голосовых связок, открывая просвет голосовой щели и свободно пропуская воздух (Evans 1993). Неспособность ДПЧ мышцы к сокращению приводит к сужению голосовой щели и появлению свистящего шума при дыхании (Monnet & Tobias 2012).
Хрящи гортани включают надгортанник, черпаловидный (парный), сесамовидный, межчерпаловидный, щитовидный и перстневидный хрящи (рис. 1). Черпаловидные хрящи имеют наиболее сложное строение. Рожковидные, клиновидные, мышечные и голосовые отростки придают им неправильную форму (Evans 1993). Мышечный отросток расположен чуть латеральнее сочленения между перстневидным и черпаловидным хрящами и служит местом прикрепления ДПЧ мышцы (Evans 1993). Рожковидный отросток – более длинный из двух дорсальных отростков, формирующий дорсальную границу входа в гортань. Другой дорсальный отросток, клиновидный, расположен более ростровентрально, чем рожковидный (Evans 1993). Вентральная часть этого отростка расположена в черпалонадгортанной складке, большей частью образующей большую часть латеральной границы входа в гортань (Evans 1993). Кольцевая форма перстневидного хряща создает жесткую структуру, поддерживающую более эластичные щитовидный и черпаловидный хрящи (Monnet & Tobias 2012).
Щитоглоточная (ЩГ) мышца расположена в дорсальной и латеральной частях глотки (Hermanson & Evans 1993). Эта мышца берет начало в латеральной части щитовидного хряща и продолжается дорсально в глотку, прикрепляясь на медиальной плоскости (Hermanson & Evans 1993). Сокращение этой мышцы вместе с перстнещитовидной мышцей вызывает сжатие гортани в средней части, способствуя глотанию и препятствуя попаданию воздуха в пищевод (Hermanson & Evans 1993). Голосовая щель открывается при сокращении ДПЧ мышцы (Hermanson & Evans 1993). Эта мышца берет начало на дорсолатеральной поверхности перстневидного хряща и прикрепляется на мышечном отростке черпаловидного хряща (Hermanson & Evans 1993). Сокращение этой мышцы вызывает смещение черпаловидного хряща в каудодорсальном направлении (отведение).
Все собственные мышцы гортани, кроме перстнещитовидной мышцы, иннервируются каудальным гортанным нервом (конечная часть возвратного гортанного нерва) (Hermanson & Evans 1993). Левый возвратный гортанный нерв (ВГН) огибает аорту и восходит по левой стороне трахеи, в то время как правый ВГН огибает правую подключичную артерию и восходит по правой стороне трахеи (Evans & Kitchell 1993). По мере своего краниального хода возвратные гортанные нервы дают начало окологортанным возвратным нервам, идущим параллельно ВГН (Evans & Kitchell 1993). Окологортанные возвратные нервы обеспечивают чувствительную иннервацию пищевода и трахеи (Evans & Kitchell 1993).
Этиологии и классификация
Паралич гортани может быть врожденным или приобретенным и, в зависимости от этиологии, одно- или двусторонним (Monnet & Tobias 2012; Stanley et al. 2010). Наследственная форма ПГ описана у хаски и фландрских бувье (O’Brien & Hendriks 1986; Venker-van Haagen 1982). У фландрских бувье встречается заболевание, связанное с гибелью двигательных нейронов в двойном ядре и наследующееся по аутосомно-доминантному типу (Parnell 2010). Это заболевание приводит к одно- или двустороннему параличу и обычно проявляется у собак в возрасте младше 12 месяцев (Burbidge 1995; O’Brien & Hendriks 1986; Ridyard et al. 2000; Venker-van Haagen 1982).
Врожденная полиневропатия с ПГ описана у ротвейлеров, фландрских бувье, бультерьеров, далматинов, немецких овчарок, афганских борзых, кокер-спаниелей, такс, карликовых пинчеров и хаски (Bennnett & Clarke 1997; Braund 1994; Braund et al. 1994; Braund et al. 1989; Eger et al. 1998; Harvey & O’Brien 1982; Mahony et al. 1998; O’Brien & Hendriks 1986; Ridyard et al. 2000; Venker-van Haagen 1982). При этом могут присутствовать клинические признаки, указывающие на полиневропатию, включая ослабление рефлексов (на всех четырех конечностях), ослабление позотонических реакций, гипотонию и атрофию мышц поясов конечностей (Braund 1994; Braund et al. 1994; Davies & Irwin 2003; Gabriel et al. 2006; Mahony et al. 1998; Ridyard et al. 2000). У молодых далматинов и ротвейлеров отмечается дегенерация аксонов с потерей миелинизированных нервных волокон ВГН и окологортанных возвратных нервов (Braund et al. 1994; Braund et al. 1989; Mahony et al. 1998). У хаски и немецких овчарок выявлена связь между ПГ и некоторыми фенотипическими особенностями, например белым окрасом, крапом и голубыми глазами (O’Brien & Hendriks 1986; Polizopoulou et al. 2003; Ridyard et al. 2000).
Приобретенный ПГ может быть обусловлен травмой ВГН или блуждающего нерва в шейной или грудной части (например, в результате укушенных ран, хирургических ран, опухоли средостения) (Monnet & Tobias 2012). Такие заболевания, как невропатии, поражение каудальной части ствола мозга, эндокринные заболевания (гипотиреоз и гипоадренокортицизм), myasthenia gravis, паранеопластические синдромы, идиопатический миозит, системная красная волчанка и отравление фосфорорганическими соединениями, также способны привести к ПГ (Burbidge 1995; Dewey et al. 1997; Kvitko-White et al. 2012; MacPhail & Monnet 2001; Michael 2002; Monnet & Tobias 2012; White 1989). Недавно был введен термин «старческий паралич гортани с полиневропатией» (СПГПН) для обозначения распространенного синдрома приобретенного идиопатического паралича гортани (ПИПГ) (Monnet & Tobias 2012; Parnell 2010; Stanley et al. 2010). Имеются веские доказательства того, что эта форма представляет собой выраженный клинический признак генерализованной периферической полиневропатии (Jeffery et al. 2006; Stanley et al. 2010). Она часто развивается у собак таких пород, как лабрадор-ретривер, ротвейлер, афганская борзая, ирландский сеттер, золотистый ретривер, сенбернар, ирландский сеттер и стандартный пудель (Gaber, Amis & Le Couteur 1985; Monnet & Tobias 2012).
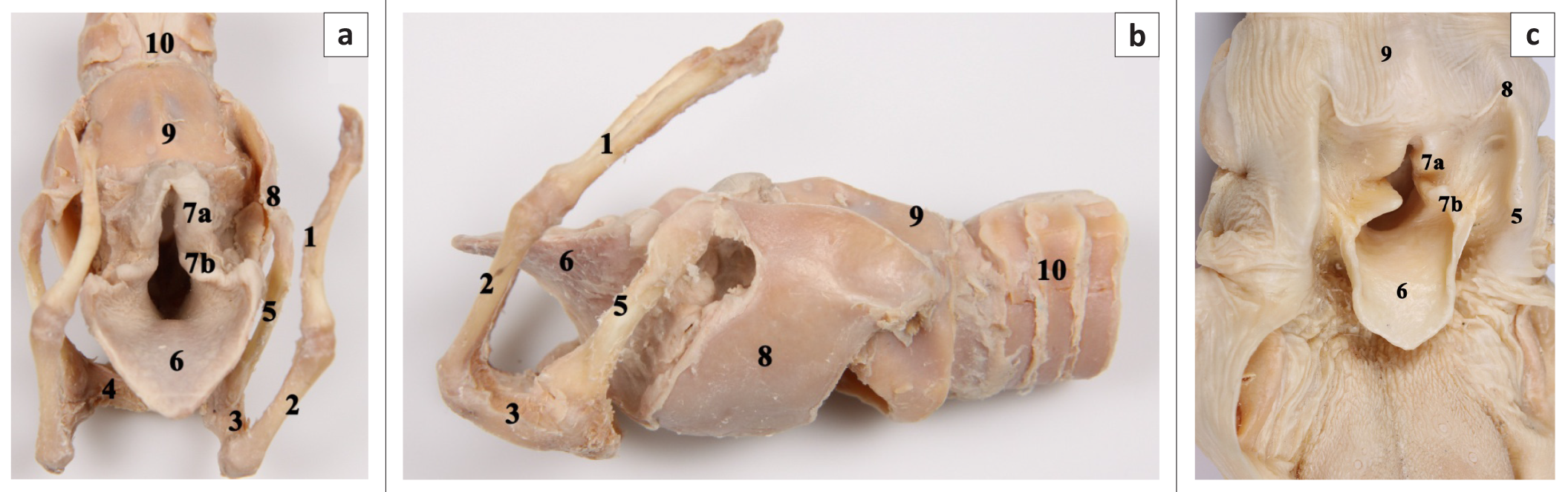
РИС. 1: консервированный образец гортани собаки, вид в (а) ростродорасальной проекции с удаленными мышцами, (b) латеральной проекции после удаления мышц и (c) ростродорсальной проекции с удаленной дорсальной частью пищевода.
На этих фото видны: (1) средний членик подъязычной кости, (2) дистальный членик подъязычной кости, (3) рог подъязычной кости, (4) тело подъязычной кости (5), гортанная ветвь, (6) надгортанник, (7a) рожковидный отросток черпаловидного хряща, (7b) клиновидный отросток черпаловидного хряща, (8) щитовидный хрящ, (9) перстневидный хрящ и (10) трахея.
В отличие от врожденной формы, ПИПГ обычно встречается у собак крупных пород среднего и пожилого возраста (Burbidge 1995; Parnell 2010), у кобелей примерно вдвое чаще, чем у сук (Burbidge, Goulden & Jones 1991; MacPhail & Monnet 2001; White 1989).
Клинические признаки
У собак с односторонним ПГ (чаще всего левосторонним) клинические симптомы появляются только во время сильных физических нагрузок (например, у рабочих собак) (Monnet & Tobias 2012). Неспособность черпаловидного хряща к отведению при вдохе усиливает сопротивление воздушному потоку, создавая турбулентность в области голосовой щели с типичным свистящим шумом при вдохе (Stanley et al. 2010; Venkervan Haagen 1982). Неспособность к натяжению голосовых связок приводит к дисфонии и изменению голоса собаки; лай становится слабым и хриплым (Parnell 2010). Частичная обструкция верхних дыхательных путей парализованными черпаловидными хрящами ведет к непереносимости физических нагрузок (Burbidge 1995; Parnell 2010).
Нарушения дыхания (которое может привести к цианозу) легко усиливаются при возбуждении, физических нагрузках, высокой температуре воздуха, отеке легких или бронхопневмонии (Millard & Tobias 2009; Monnet & Tobias 2012; Parnell 2010). Кроме того, функциональная обструкция дыхательных путей может усилиться при вторичном отеке гортани и воспалении (Harvey & O’Brien 1982; Millard & Tobias 2009). У собак с избыточным весом и ПГ клинические признаки проявляются тяжелее, чем у животных с нормальной упитанностью (Broome, Burbidge & Pfeiffer 2000).
Современные методы диагностики позволяют выявить сопутствующую бронхопневмонию, мегаэзофагус, грыжу пищеводного отверстия или желудочно-пищеводный рефлюкс (Burnie, Simpson & Corcoran 1989; Stanley et al. 2010). Эти нарушения могут проявляться чрезмерным кашлем, рвотными движениями и регургитацией. В одном исследовании было обнаружено снижение моторики пищевода у всех 32 собак с ПИПГ (Stanley et al. 2010). Это было обусловлено периферической невропатией и сильнее проявлялось при кормлении жидкой пищей (Stanley et al. 2010). Ослабление моторики пищевода не всегда проявляется клинически (Stanley et al. 2010). Дисфагия может быть симптомом периферической полиневропатии и иногда наблюдается у пациентов с ПГ (Monnet & Tobias 2012). Врожденный ПГ у собак обычно является результатом комплекса полиневропатии и проявляется до 12-месячного возраста (Monnet & Tobias 2012). Эта форма заболевания характеризуется симптомами ПГ в сочетании с катарактой и неврологическими симптомами, такими как тетрапарез (сильнее на тазовых конечностях), ослабление рефлексов на всех четырех конечностях, ослабление позотонических реакций, гипотонус и атрофия мышц поясов конечностей (Braund 1994; Braund et al. 1994; Davies & Irwin 2003; Gabriel et al. 2006; Mahony et al. 1998; Ridyard et al. 2000). Также возможны сопутствующие заболевания, такие как мегаэзофагус и аспирационная пневмония, которые присутствуют изначально или развиваются по мере прогрессирования болезни (Braund 1994; Braund et al. 1994; Mahony et al. 1998; Ridyard et al. 2000).
В одном исследовании у всех 15 собак с ПИПГ, прошедших полное неврологическое обследование, были обнаружены неврологические нарушения в дополнение к респираторным проблемам (Jeffery et al. 2006). Эти нарушения включали ослабление позотонических реакций, нарушения спинномозговых рефлексов и функции черепномозговых нервов (Jeffery et al. 2006). Клинические признаки, связанные с генерализованной полиневропатией, бывают слабыми, поэтому обследовать собаку с диспноэ необходимо внимательно, чтобы не пропустить их (Jeffery et al. 2006). Неврологическое нарушение (атаксия) тазовых конечностей у таких пожилых собак часто ошибочно принимают за слабость или ортопедические проблемы (Jeffery et al. 2006). Такая генерализованная полиневропатия – медленно прогрессирующее дегенеративное состояние, поражающее периферические нервы (Stanley et al. 2010). До развития очевидных клинических признаков общей полиневропатии и дисфагии может пройти несколько месяцев или лет (Jeffery et al. 2006; Stanley et al. 2010).
Диагноз
Паралич гортани следует подозревать у любого пациента со свистящими шумами при вдохе, измененным хриплым голосом и непереносимостью нагрузок. Инспираторная одышка не исчезает при дыхании с открытым ртом и усиливается при легком боковом нажатии на гортань (Monnet & Tobias 2012).
Клинические симптомы и данные о породе, поле, возрасте – неотъемлемая часть диагностики ПГ. У фландрских бувье и хаски моложе 12 месяцев только в случае наличия респираторных проблемам следует подозревать наследственный ПГ (O’Brien & Hendriks 1986; Venker-van Haagen 1982). У собак среднего возраста с респираторными нарушениями, характерными для ПГ, в сочетании с неврологической дисфункцией возможен врожденный ПГ, развивающийся в основном на фоне периферической полиневропатии (Monnet & Tobias 2012). У пожилых собак с непереносимостью нагрузок, свистящим шумом при вдохе и дисфонией следует подозревать ПИПГ. Диагностика на основании породы, пола, возраста и анамнеза обладает специфичностью 91,6% и чувствительностью 98,5% для всех собак с параличом гортани 3 и 4 степени (Broome et al. 2000).
Осмотр гортани необходим для исключения других причин свистящего шума (например, опухоли гортани) и подтверждения предположительного диагноза ПГ (Broome et al. 2000). Непосредственная визуализация гортани возможна с помощью трансанальной или пероральной ларингоскопии. Так как согласие результатов исследования последним способом у разных наблюдателей достигает 95%, он считается «золотым стандартом» диагностики (Broome et al. 2000; Radlinsky et al. 2009; Smith 2000). Преимуществом трансанальной ларингоскопии является возможность ее проведения у крупных собак только под седацией и местной анестезией (Radlinsky, Mason & Hodgson 2004).
Перед осмотром гортани собаке устанавливают внутривенный катетер и дают кислород минимум на 3-5 минут (Millard & Tobias 2009; Smith 2000). Собаку укладывают на грудь и удерживают голову в нормальном анатомическом положении (Gross et al. 2002; Jackson et al. 2004; Smith 2000). Во избежание ложноположительного диагноза наркоз должен быть неглубоким (Gross et al. 2002; Jackson et al. 2004; Monnet & Tobias 2012; Smith 2000). Цель – расслабление мышц челюстей без изменения рефлексов гортани или подавления дыхательных движений (Burbidge 1995). Таких проколов анестезии, как сочетание диазепама-кетамина, следует избегать из-за плохого расслабления мышц и недостаточных условий для осмотра гортани во время ларингоскопии (Gross et al. 2002). В одном исследовании при применении комбинаций ацепромазина-пропофола, ацепромазина-тиопентала или диазепама-кетамина у половины здоровых собак отсутствовало отведение черпаловидного хряща при вдохе (ложноположительный диагноз) (Jackson et al. 2004). В этом же исследовании было сделано заключение, что внутривенное введение тиопентала в качестве единственного препарата лучше всего сохраняло функцию гортани (Jackson et al. 2004). В то время как индукция тиопенталом вызывает угнетение дыхания, очень легкий наркоз приводит к учащению дыхания, что идеально для оценки гортани (Turner & Ilkiw 1990). Исследование пациентов с подозрением на ПГ следует продолжать почти до выхода из наркоза (Burbidge 1995). Если результаты осмотра гортани не позволяют сделать заключение, для дифференциации здоровых собак и собак с ПГ можно ввести доксапрама гидрохлорид (1,1 мг/кг), индуцирующий глубокие дыхательные движения (Tobias, Jackson & Harvey 2004). Однако повышение скорости воздушного потока приведет к усилению отрицательного давления в дыхательных путях и парадоксальному движению черпаловидного хряща, которое может привести к полной обструкции гортани (Tobias et al. 2004).
Осмотр гортани включает оценку черпаловидного хряща на способность к активному отведению при вдохе и пассивному приведению при выдохе (Monnet & Tobias 2012). Неподвижные черпаловидные хрящи и голосовые связки у собаки под соответствующим наркозом указывают на двусторонний ПГ, в то время как асимметричное движение черпаловидных хрящей указывает на одностороннее заболевание (Monnet & Tobias 2012). Во избежание ложноотрицательного диагноза ПГ у пациентов с парадоксальным движением черпаловидных хрящей можно попросить ассистента сообщать врачу, осматривающему гортань, о наступлении фазы вдоха. Парадоксальное движение у пациентов с ПГ наблюдается при усилении отрицательного давления в дыхательных путях во время вдоха, что вызывает приведение черпаловидного хряща, а в последующем положительное давление при выдохе - к его пассивному возврату в положение покоя (Burbidge 1995). Это встречается примерно у 45% собак с ПГ (Olivieri, Voghera & Fossum 2009). Чрезмерное отрицательное давление может привести к вторичному удлинению мягкого неба и вывороту гортанных мешочков (Millard & Tobias 2009). Непрерывное трение черпаловидных хрящей друг о друга может стать причиной изъязвления слизистой оболочки и отека на уровне рожковидных отростков (Monnet & Tobias 2012).
Прочие методы диагностики, такие как определение звуковой сигнатуры, оценка петли поток-объем при спокойном дыхании, электромиография, анализ газов крови и плетизмография, могут помочь подтвердить диагноз ПГ (Amis & Kurpershoek 1986; Bedenice et al. 2006; Burbidge 1995; Yeon et al. 2005). Эхоларингография применялась при исследованиях, однако показала себя менее чувствительным методом диагностики ПГ по сравнению с непосредственной визуализацией (Radlinsky et al. 2009; Rudorf, Barr & Lane 2001).
Всем собакам с подозрением на ПГ показана рентгенография грудной клетки для облегчения диагностики основных заболеваний, например новообразований в области шеи и краниальной части средостения, а также выявления других патологий, таких как мегаэзофагус, аспирационная пневмония и некардиогенный отек легких (Monnet & Tobias 2012). У собак с подозрением на мегаэзофагус для подтверждения диагноза можно провести исследование с контрастом, хотя оно не проводится планово из-за повышенного риска аспирации (Millard & Tobias 2009). 7-14% пациентов с подтвержденным параличом гортани в последующем ставится диагноз гипотиреоза (Asulp et al. 1997; Dixon, Reid & Mooney 1999; Jaggy et al. 1994; White 1989; Zikes & McCarthy 2012). Собакам с клиническими признаками слабости, мегаэзофагусом, другими периферическими или центральными неврологическими симптомами, непереносимостью физических нагрузок, изменениями кожи (гиперпигментация, алопеция, плохое качество шерсти и пиодерма), вялостью или ожирением следует сделать анализ на свободный тироксин и тиреостимулирующий гормон (Jaggy et al. 1994; Jeffery et al. 2006).
Myasthenia gravis – нечастое заболевание, сопровождающееся ПГ (Jeffery et al. 2006). У собак с ПГ и клиническими признаками регургитации (мегаэзофагус), дисфагии, множественных нарушений черепно-мозговых нервов, генерализованной или локальной нервно-мышечной слабостью или непереносимостью нагрузок необходимо определить титр антител к рецептору ацетилхолина для исключения myasthenia gravis (Shelton 2002). Приобретенная myasthenia gravis может быть связана с гипотиреозом или гипоадренокортицизмом, или развиться как паранеопластический синдром при тимоме, остеогенной саркоме, холангиогенном раке и кожной лимфоме (Shelton 2002). При постановке диагноза myasthenia gravis следует попытаться исключить эти первичные нарушения.
Медикаментозное лечение дыхательных нарушений
У пациентов с ПГ возможно острое нарушение дыхания, приводящее к цианозу и гипертермии (Burbidge 1995). При этом необходимо неотложное лечение, включающее кислород, седативные средства и охлаждение пациента (Burbidge 1995; Millard & Tobias 2009). Выбор способа введения кислорода основывается на переносимости пациентом; это может быть помещение в клетку с кислородом, подача газообразного кислорода без дополнительных приспособлений, кислородная палатка, лицевая маска или носовая канюля (Mazzaferro 2009). Если цианоз, одышка и гипоксия (SPO2 <95%) сохраняются, несмотря на подачу кислорода, следует рассмотреть вариант временной трахеостомии или временной интубации под легким наркозом, пока не спадет отек гортани или не появится возможность хирургической коррекции (Millard & Tobias 2009). Временную интубацию выбирают, если ожидается, что длительность интубации не превысит пары часов, в то время как для долговременного лечения применяют трахеостомические трубки (Millard & Tobias 2009). Жидкости вводят осторожно в связи с риском отека легких у животных с тяжелой обструкцией верхних дыхательных путей (Monnet & Tobias 2012). Рекомендована седация ацепромазином (0,005 мг/кг – 0,020 мг/кг) и буторфанолом (0,200 мг/кг – 0,400 мг/кг) (Millard & Tobias 2009). Кроме того, в случаях отека гортани можно вводить короткодействующие кортикостероиды, такие как дексаметазон (0,100 мг/кг) или преднизолона натрия сукцинат (0,200-0,400 мг/кг) (Millard & Tobias 2009). Гипертермию следует дифференцировать от истинной лихорадки, которая может развиться из-за аспирационной пневмонии. Температура ниже 41оС не угрожает жизни, если не держится долго, и меры по охлаждению пациентов следует принимать только при повышении температуры более этого значения (Mazzaferro 2009; Millard & Tobias 2009). Для охлаждения можно остричь шерсть, намочить животное, приложить пакеты со льдом к поверхностям с большим количеством сосудов (шея, подмышечные и паховые области), обдувать мокрое животное вентилятором или вводить холодные изотонические жидкости ректально (Mazzaferro 2009). Важно непрерывно контролировать температуру и прекратить охлаждающие процедуры сразу после того, как температура достигнет 39,4°C, во избежание гипотермии (Mazzaferro 2009).
Консервативное лечение можно рассматривать для пожилых пациентов с ПГ и с клиническими симптомами от минимальной до умеренной выраженности. Оно включает противовоспалительные препараты для снижения отека гортани и программу снижения веса для животных с избыточным весом (MacPhail & Monnet 2008). Кроме того, владельцам следует рассказать об изменении ухода за пациентом и условий содержания. Необходимо предоставить животному прохладное место, особенно в теплые месяцы года. Не следует допускать напряженной физической активности. В более прохладные периоды суток допустимы короткие прогулки на шлейке.
Хирургическое лечение путем латерализации перстневидного и черпаловидного хряща
Хирургическое лечение рекомендуется всем пациентам с ПГ и тяжелыми клиническими симптомами (MacPhail & Monnet 2008; Monnet & Tobias 2012). Целью хирургического вмешательства является увеличение просвета голосовой щели (LaHue 1989; Millard & Tobias 2009; Monnet & Tobias 2012). Так как сопротивление воздушному потоку обратно пропорционально радиусу в четвертой степени по закону Пуазейля, даже небольшое увеличение даст значимую разницу (Monnet & Tobias 2012).
Разработано множество хирургических техник, которые успешно применяются. Их можно классифицировать как внутри- или внегортанные процедуры (рис. 2 и 3). Латерализация перстневидного и черпаловидного хряща в настоящее время считается предпочтительным методом (Monnet & Tobias 2012). Целью процедуры является предотвращение пассивного приведения черпаловидного хряща во время вдоха путем его фиксации в положении от нейтрального до слегка смещенного вбок (техника малого натяжения) (Bureau & Monnet 2002). Такая модификация не препятствует достаточному закрытию голосовой щели надгортанником во время глотания и, как полагают, уменьшает осложнения, связанные с аспирацией (Bureau & Monnet 2002). Для односторонней латерализации перстневидного и черпаловидного хряща (ОЛПЧХ) применяется боковой доступ (LaHue 1989; Monnet & Tobias 2012). Собакам с односторонним ПГ коррекцию проводят в зависимости от пораженной стороны, а собакам с двухсторонним ПГ латерализацию выполняют слева, если хирург правша (MacPhail & Monnet 2001; Monnet & Tobias 2012). Односторонней коррекции достаточно для облегчения клинических признаков у большинства собак с двухсторонним параличом (Monnet & Tobias 2012).
Под шею собаки подкладывают мешок с песком, чтобы поднять область гортани, и делают разрез кожи над гортанью чуть вентральнее яремной вены (Monnet & Tobias 2012). Обнажают ЩГ мышцу путем рассечения в сочетании с тупым разделением подкожной мускулатуры (подкожной мышцы шеи и поверхностного сжимателя шеи). Затем эту мышцу надрезают у дорсокаудального края пластины щитовидного хряща, избегая разреза слизистой оболочки гортани. В качестве альтернативы можно расщепить ЩГ мышцу вдоль в направлении мышечных волокон (Nelissen & White 2011). Если требуется расширить доступ, у взрослой собаки можно разделить сустав между перстневидным и щитовидным хрящами или наложить фиксирующий шов через пластинку щитовидного хряща для нетравматичного отведения вбок. Мышечный отросток черпаловидного хряща обычно выступает и легко пальпируется из-за неврогенной атрофии ДПЧ мышцы (Griffn & Krahwinkel 2005). Делают поперечный разрез ДПЧ мышцы и осторожно продолжают рассечение до тех пор, пока не покажется сустав между перстневидным и черпаловидным хрящами (Monnet & Tobias 2012). При рассечении перстнечерпаловидного сустава краниальную часть суставной капсулы оставляют нетронутой (Bureau & Monnet 2002). Для фиксации черпаловидного хряща рекомендуется нерассасывающийся моноволоконный шовный материал (например, полипропилен) или уплощенные иглы с присоединенной нитью. В зависимости от размера собаки используют размер 2/0 (40 кг) по Фармакопее США (Demetriou & Kirby 2003). Нить закрепляют с дорсальной стороны на каудальном крае перстневидного хряща, следя, чтобы не попасть в просвет гортани. После выполнения этого шага рекомендуется слегка вытянуть интубационую трубку, чтобы убедиться, что она случайно не захвачена шовным материалом (Weinstein & Weisman 2010). Затем через мышечный отросток черпаловидного хряща вводят иглу в медио-латеральном направлении (Monnet & Tobias 2012). У пожилых собак хрящи гортани могут быть хрупкими и надрываться при наложении швов (Monnet & Tobias 2012). По этой причине очень важно снизить риск разрыва или даже перелома хряща при затягивании петель шовного материала. Некоторые авторы рекомендуют проделать в черпаловидном хряще небольшое отверстие иглой для подкожных инъекций 18G перед тем, как вводить иглу с шовным материалом (Monnet & Tobias 2012).
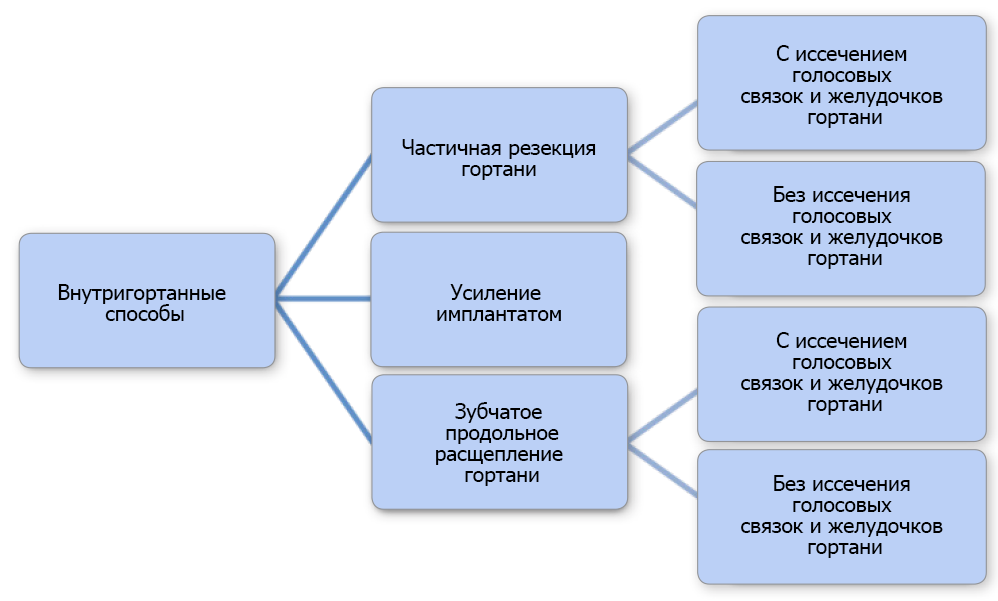
РИС. 2: Схема, показывающая разные внутригортанные хирургические процедуры у собак с параличом гортани.
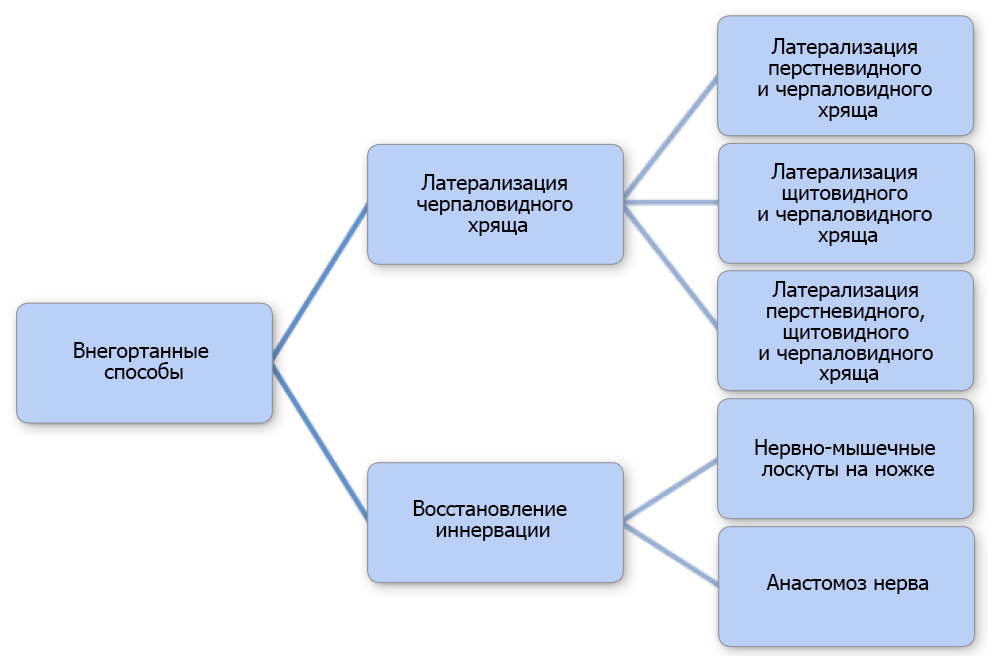
РИС. 3. Схема, показывающая различные внегортанные хирургические процедуры для собак с параличом гортани.
Шовный материал осторожно завязывают, пока не начнет ощущаться сопротивление из-за напряженной оставшейся части суставной капсулы (Bureau & Monnet 2002). Другой вариант – это завязывать узлы при непосредственной эндоскопической визуализации после временной экстубации (Weinstein & Weisman 2010). Достаточное отведение определяется как любая степень отведения, приводящая к увеличению диаметра голосовой щели без осевого смещения зависимой (не подвергнутой хирургическому вмешательству) стороны (Weinstein & Weisman 2010) (рис. 4). Необходимо тщательно восстановить положение ЩГ мышцы с помощью непрерывного шва рассасывающейся мононитью для снижения риска послеоперационного расстройства глотания (Nelissen & White 2011). Подкожные ткани ушивают в два слоя, кожу ушивают обычным способом.
Послеоперационные осложнения возникают у 10-58% собак (Gaber et al. 1985; Hammel, Hottinger & Novo 2006; MacPhail & Monnet 2001; Snelling & Edwards 2003). Они включают рвотные позывы или кашель, аспирационную пневмонию, рецидив клинических симптомов (в результате несостоятельности имплантата или разрыва хряща), остаточный свистящий шум при дыхании, расстройство дыхания, расширение-заворот желудка, формирование серомы или гематомы, а также смерть (Millard & Tobias 2009; Monnet & Tobias 2012). Следует учитывать, что риск развития послеоперационных осложнений со стороны органов дыхания у собак сохраняется пожизненно (MacPhail & Monnet 2001). Аспирационная пневмония – самое распространенное осложнение, возникающее примерно у 8-24% собак после операции (Demetriou & Kirby 2003; Hammel et al. 2006; MacPhail & Monnet 2001; Snelling & Edwards 2003; White 1989). Полагают, что техники малого натяжения снижают риск послеоперационной аспирационной пневмонии (Bureau & Monnet 2002).
Примерно у 5% пациентов возникает необходимость во вмешательстве с противоположной стороны из-за фрагментации черпаловидного хряща, отрыва шовного материала, наложенного с целью латерализации или недостаточной латерализации (White 1989). Рецидив клинических признаков после операции чаще наблюдается у собак мелких пород (Snelling & Edwards 2003). Хорошее знание анатомии, осторожное обращение с тканями и избегание проникающих проколов в просвет гортани помогают свести к минимуму риск осложнений в послеоперационный период (Monnet & Tobias 2012). Факторы, отрицательно влияющие на исход хирургического вмешательства, включают возраст, сопутствующие нарушения дыхательных путей, заболевания пищевода, неврологические заболевания или опухоли, а также временную трахеостомию (MacPhail & Monnet 2001). Односторонняя латерализация перстневидного и черпаловидного хряща дает хороший клинический результат, у 88-90% собак отмечается улучшение качества жизни в послеоперационный период (Hammel et al. 2006; Snelling & Edwards 2003). Существуют варианты этой техники, при которых черпаловидный хрящ также фиксируют к щитовидному (латерализация перстневидного, щитовидного и черпаловидного хрящей) или только к щитовидному хрящу (латерализация щитовидного и черпаловидного хрящей) (Monnet & Tobias 2012). При последней технике расширение голосовой щели менее выраженное (хотя удовлетворительное) по сравнению с латерализацией перстневидного и черпаловидного хрящей, а операция занимает меньше времени (Griffths, Sullivan & Reid 2001). Клинические исходы ОЛПЧХ и латерализации щитовидного и черпаловидного хрящей сопоставимы (Griffths et al. 2001).
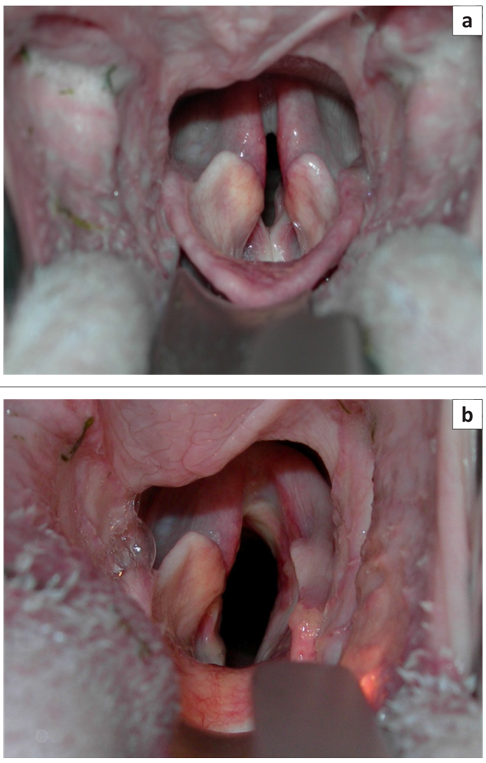
РИС. 4: Осмотр гортани у 10-летней мальтийской болонки с параличом гортани: (а) вид до операции и (b) отведение левого черпаловидного хряща после односторонней латерализации.
Прочие хирургические техники
Постоянная трахеостомия заключается в формировании пути для воздуха в обход гортани (Monnet & Tobias 2012). Она применяется для пациентов с риском послеоперационной аспирационной пневмонии, например пациентов с генерализованной миопатией, мегаэзофагусом, грыжей пищеводного отверстия и желудочно-кишечными нарушениями (Monnet & Tobias 2012).
Частичная резекция гортани (рис. 5) – более старая техника, заключающаяся в удалении голосовых связок и значительной части рожковидных и голосовых отростков (одностороннем или двухстороннем) с целью устранения препятствий для воздушного потока без снижения защитного эффекта дыхательных путей (Harvey 1983a, 1983b). Эта процедура может привести к значительному послеоперационному отеку, иногда требующему временной трахеостомии. Осложнения наблюдаются примерно у 50% собак и включают постоянный свистящий шум в верхних дыхательных путях, кашель, рвоту, аспирационную пневмонию, формирование мембран гортани и непереносимость физических нагрузок (Harvey 1983a; Harvey & O’Brien 1982; MacPhail & Monnet 2001; Ross et al. 1991) (табл. 1). Недавно эта забытая техника снова обрела популярность в связи с введением метода трансоральной резекции черпаловидного хряща с помощью диодного лазера. У 20 собак не выявлено осложнений в непосредственный послеоперационный период, и всего у 10% развилась аспирационная пневмония через длительное время после операции (Olivieri et al. 2009). Недавнее ретроспективное исследование удаления голосовых связок и желудочков гортани путем вентральной ларинготомии показало некоторые многообещающие результаты с ограниченным количеством осложнений, как через короткое, так и через длительное время после операции. Авторы этой статьи пришли к заключению, что в связи с простотой процедуры, ограниченным числом осложнений и минимальной хирургической травмой, эту технику следует рассматривать в качестве планового метода (Zikes & McCarthy 2012).
Продольное зубчатое расщепление гортани – еще одна устаревшая процедура, заключающаяся в увеличении вентрального отверстия гортани путем ушивания зазубренного разреза в вентральной части щитовидного хряща со смещением (рис. 6). Эта процедура технически сложна, приводит к тяжелому послеоперационному отеку гортани и требует временной трахеостомии на 2-3 дня после операции (Monnet & Tobias 2012). Результаты этой процедуры варьировали, и от нее отказались (Burbidge et al. 1991).
Техники восстановления иннервации и нервно-мышечные лоскуты на ножке применялись для восстановления функции отведения у собак после экспериментальной денервации (Greenfeld et al. 1988; Paniello, West & Lee 2001; Rice 1982). Эти техники могут быть полезны для пациентов с приобретенным травматическим ПГ. Вероятно, что они будут неэффективны для пациентов с полиневропатией или полимиопатией в качестве основной причины (Monnet & Tobias 2012). Их плановое применение также находится под вопросом, так как на восстановление функции гортани требуется не менее 5 месяцев (Greenfeld et al. 1988).
Усиление гортани при помощи имплантируемых устройств описано ex vivo (Cabano et al. 2011) и in vivo (Kwon et al. 2007) у собак. Клинических данных о доступных в настоящее время устройствах недостаточно, поэтому рекомендовать их применение на данный момент нельзя.
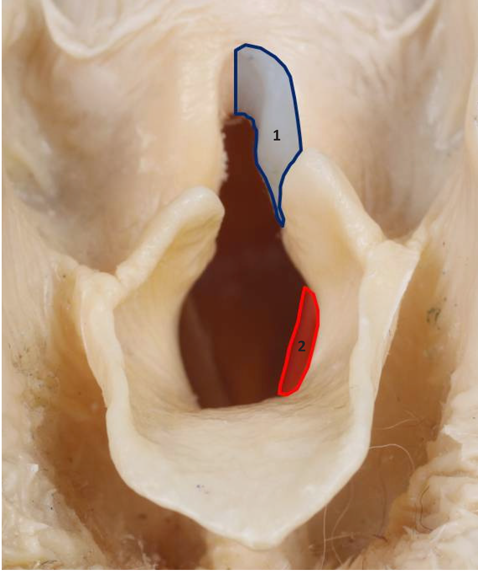
РИС. 5: Схематическое изображение односторонней частичной резекции гортани на консервированном трупном образце гортани собаки; область удаления черпаловидного хряща показана синим (1), а расположение голосовых связок – красным (2).
Таблица 1: методы хирургического лечения с опубликованными процентными данными об улучшении, аспирационной пневмонии, незначительных осложнениях (постоянный свистящий шум, кашель, рвотные движения, учащенное дыхание, формирование серомы, непереносимость нагрузок или рвота), формировании мембран и смертности.
| Метод лечения |
Улучшение (%) |
Аспирационная пневмония (%) |
Незначительные осложнения (%) |
Формирование мембран (%) |
Смертность (%) |
| Односторонняя латерализация черпаловидного хряща1,2,3,4,5 |
90 |
10–28 |
9–56 |
- |
0–14 |
| Двухстороння латерализация черпаловидного хряща6,4 |
- |
11–89 |
- |
- |
67 |
| Двухстороння латерализация черпаловидного хряща с удалением желудочков гортани и голосовых связок7 |
88 |
15 |
30 |
- |
0 |
| Зубчатый продольный разрез гортани с удалением желудочков гортани и голосовых связок6 |
100 |
- |
40 |
40 |
- |
| Частичная резекция гортани, трансоральный доступ с удалением желудочков гортани и голосовых связок или без4,8,9 |
88–90 |
6–33 |
44 |
8–14 |
30 |
| Частичная резекция гортани, трансоральный доступ – диодный лазер10 |
100 |
10 |
- |
0 |
- |
| Удаление желудочков гортани и голосовых связок, трансоральный доступ11,12 |
83 |
15 |
40–73 |
13 |
- |
| Удаление желудочков гортани и голосовых связок, вентральный доступ13 |
93 |
3 |
6 |
0 |
- |
1, Demetriou and Kirby (2003); 2, Grifths et al. (2001); 3, Hammel et al. (2006); 4, MacPhail and Monnet (2001); 5, White (1989); 6, Burbridge et al. (1998); 7, Schofeld et al. (2007); 8, Ross et al. (1991); 9, Trout et al. (1994); 10, Olivieri et al. (2009); 11, Asulp et al. (1997); 12, Holt and Harvey (1994); 13, Zikes and McCarthy (2012).
Подробнее об этих источниках см. в полном списке литературы к этой статье: Kitshof A.M., Van Goethem B., Stegen L., Vandekerckhove P. & De Rooster H., 2013, ‘Laryngeal paralysis in dogs: An update on recent knowledge’, Journal of the South African Veterinary Associaton 84(1), Art. #909, 9 pages. htp://dx.doi.org/10.4102/jsava.v84i1.909.
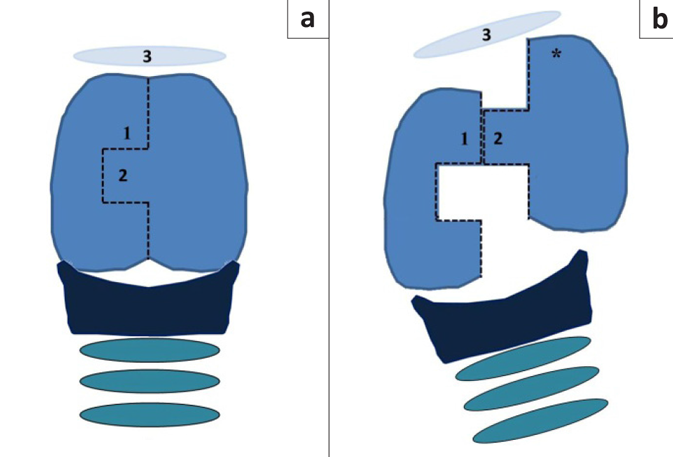
РИС. 6: схематическое изображение техники зубчатого продольного разреза гортани, показывающее (а) щитовидный хрящ с вентральной стороны со ступенчатым разрезом и (b) смещение лоскута хряща вперед.
Послеразрезахрящалоскут 2 смещаютвпередирасполагаютлатеральнопо отношению к части 1, как показано на рисунке. Краниальную границу сегмента щитовидного хряща, смещенного краниально (*), подшивают к телу подъязычной кости (3) двумя простыми узловыми швами нерассасывающимся моноволоконным материалом 2/0. Совмещенные края ростральной трети (между 1 и 2) сшивают этим же шовным материалом.
РИС. 6: схематическое изображение техники зубчатого продольного разреза гортани, показывающее (а) щитовидный хрящ с вентральной стороны со ступенчатым разрезом и (b) смещение лоскута хряща вперед.
Послеоперационный уход
После хирургического лечения частичная обструкция гортани ослабевает и дыхание сразу облегчается. При необходимости применяют кислородную терапию, а для снижения припухлости и отека гортани во время операции можно вводить дексаметазона натрия фосфат (0,1-1,0 мг/кг) (Monnet & Tobias 2012). За 12 ч до операции убирают корм и воду. В послеоперационный период следует избегать глубокой седации, чтобы сохранить глотательные рефлексы (Monnet & Tobias 2012). Сначала пациенту предлагают консервированный корм, скатанный в шарики (Monnet & Tobias 2012). При отсутствии кашля или рвотных движений можно предложить немного воды (Monnet & Tobias 2012). Решение о назначении антибиотиков после операции принимается индивидуально в каждом случае.
Прогноз и заключения
Необходимо четко различать разные формы заболевания. При наследственном ПГ собак прогноз после хирургического лечения превосходный. При врожденном ПГ вследствие невропатии прогноз неблагоприятный, и большинство собак подвергается эутаназии в течение 10 недель из-за ухудшения клинических симптомов (Davies & Irwin 2003). Прогноз при приобретенном ПГ зависит от причины: в случаях травмы возможно излечение; при ПГ в результате опухоли прогноз зависит от типа опухоли.
Существуют веские доказательства того, что самая распространенная форма ПГ у собак фактически представляет собой раннюю стадию СПГПН (Stanley et al. 2010). Хотя при установлении прогноза для любой собаки с ПГ, развившемся как компонент полиневроатии, следует учитывать все осложнения, это состояние прогрессирует медленно, что улучшает краткосрочный прогноз.
Литература
- Amis, T.C. & Kurpershoek, C., 1986, ‘Tidal breathing flow-volume loop analysis for clinical assessment of airway obstruction in conscious dogs’, American Journal of Veterinary Research 47, 1002–1006. PMid:3717718
- Alsup, J.C., Greenfeld, C.L., Hungerford, McKiernan, B.C. & Whiteley, H.E., 1997, ‘Comparison of unilateral arytenoid lateralization and ventral ventriculocordectomy for the treatment of experimentally induced laryngeal paralysis in dogs’, Canadian Veterinary Journal 38(5), 287–293.
- Bedenice, D., Rozanski, E., Bach, J., Lofgren, J. & Hoffman, A.M., 2006, ‘Canine awake head-out plethysmography (HOP): Characterization of external resistive loading and spontaneous laryngeal paralysis’, Respiratory Physiology and Neurobiology 151, 61–73. http://dx.doi.org/10.1016/j.resp.2005.05.030, PMid:16055393
- Bennnett, P.F. & Clarke, R.E., 1997, ‘Laryngeal paralysis in a Rottweiler with neuroaxonal dystrophy’, Australian Veterinary Journal 75, 784–786. http://dx.doi. org/10.1111/j.1751-0813.1997.tb15650.x
- Braund, K.G., 1994, ‘Pediatric neuropathies’, Seminars in Veterinary Medicine and Surgery (Small Animal) 9, 86–98.
- Braund, K.G., Shores, A., Cochrane, S., Forrester, D., Kwiecien, J.M. & Steiss, J.E., 1994, ‘Laryngeal paralysis-polyneuropathy complex in young Dalmations’, American Journal of Veterinary Research 55, 534–542. PMid:8017700
- Braund, K.G., Steinberg, H.S., Shores, A., Steiss, J.E., Mehta, J.R., Toiviokinnucan, M. et al., 1989, ‘Laryngeal paralysis in immature and mature dogs as one sign of a more diffuse polyneuropathy’, Journal of the American Veterinary Medical Association 194, 1735–1740. PMid:2546908
- Broome, C., Burbidge, H.M. & Pfeiffer, D.U., 2000, ‘Prevalence of laryngeal paresis in dogs undergoing general anaesthesia’, Australian Veterinary Journal 78, 769–772. http://dx.doi.org/10.1111/j.1751-0813.2000.tb10449.x, PMid:11194723
- Burbidge, H., 1995, ‘A review of laryngeal paralysis in dogs’, British Veterinary Journal 151, 71–82. http://dx.doi.org/10.1016/S0007-1935(05)80066-1
- Burbidge, H.M., Goulden, E. & Jones, B.R., 1991, ‘An experimental evaluation of castellated laryngofissure and bilateral arytenoid lateralisation for the relief of laryngeal paralysis in dogs’, Australian Veterinary Journal 68, 268–272. http:// dx.doi.org/10.1111/j.1751-0813.1991.tb03239.x, PMid:1953550
- Bureau, S. & Monnet, E., 2002, ‘Effects of suture tension and surgical approach during unilateral arytenoid lateralization on the rima glottidis in the canine larynx’, Veterinary Surgery 31, 589–595. http://dx.doi.org/10.1053/jvet.2002.34671, PMid:12415529
- Burnie, A., Simpson, J. & Corcoran, B., 1989, ‘Gastrooesophageal reflux and hiatus-hernia associated with laryngeal paralysis in a dog’, Journal of Small Animal Practice 30, 414–416. http://dx.doi.org/10.1111/j.1748-5827.1989.tb01595.x
- Cabano, N.R., Greenberg, M.J., Bureau, S. & Monnet, E., 2011, ‘Effects of bilateral arytenoid cartilage stenting on canine laryngeal resistance ex vivo’, Veterinary Surgery 40, 97–101. http://dx.doi.org/10.1111/j.1532-950X.2010.00753.x, PMid:21062323
- Davies, D.R. & Irwin, P.J., 2003, ‘Degenerative neurological and neuromuscular disease in young rottweilers’, Journal of Small Animal Practice 44, 388–394. http://dx.doi. org/10.1111/j.1748-5827.2003.tb00173.x, PMid:14510327
- Demetriou, J.L. & Kirby, B.M., 2003, ‘The effect of two modifications of unilateral arytenoid lateralization on rima glottidis area in dogs’, Veterinary Surgery 32, 62–68. http://dx.doi.org/10.1053/jvet.2003.50000, PMid:12520491
- Dewey, C., Bailey, C., Shelton, G., Kass, P. & Cardinet, G., 1997, ‘Clinical forms of acquired myasthenia gravis in dogs: 25 cases (1988–1995)’, Journal of Veterinary Internal Medicine 11, 50–57. http://dx.doi.org/10.1111/j.1939-1676.1997. tb00073.x, PMid:9127290
- Dixon, R.M., Reid, S.W.J. & Mooney, C.T., 1999, ‘Epidemiological, clinical and biochemical characteristics of canine hypothyroidism’, Veterinary Record 145, 481–487.
- Eger, C.E., Huxtable, C.R.R., Chester, Z.C. & Summers, B.A., 1998, ‘Progressive tetraparesis and laryngeal paralysis in a young Rottweiler with neuronal vacuolation and axonal degeneration: An Australian case’, Australian Veterinary Journal 76, 733–737. http://dx.doi.org/10.1111/j.1751-0813.1998.tb12301.x, PMid:9862062
- Evans, H.E., 1993, ‘The respiratory system’, in M.E. Miller & H.E. Evans (eds.), Miller’s anatomy of the dog, 3rd edn., pp. 463–493, Saunders, Philadelphia. PMid:8403598
- Evans, H.E. & Kitchell, R.L., 1993, ‘Cranial nerves and cutaneous innervation of the head’, in M.E. Miller & H.E. Evans (eds.), Miller’s anatomy of the dog, 3rd edn., pp. 953–987, Saunders, Philadelphia.
- Gaber, C., Amis, T. & Le Couteur, R., 1985, ‘Laryngeal paralysis in dogs – A review of 23 cases’, Journal of the American Veterinary Medical Association 186, 377–380. PMid:3972696
- Gabriel, A., Poncelet, L., Van Ham, L., Clercx, C., Braund, K.G., Bhatti, S. et al., 2006, ‘Laryngeal paralysis-polyneuropathy complex in young related Pyrenean mountain dogs’, Journal of Small Animal Practice 47, 144–149. http://dx.doi. org/10.1111/j.1748-5827.2006.00058.x, PMid:16512846
- Greenfield, C.L., Walshaw, R., Kumar, K., Lowrie, C.T. & Derksen, F.J., 1988, ‘Neuromuscular pedicle graft for restoration of arytenoid abductor function in dogs with experimentally induced laryngeal hemiplegia’, American Journal of Veterinary Research 49, 1360–1366. PMid:3178033
- Griffin, J. & Krahwinkel, D., 2005, ‘Laryngeal paralysis: Pathophysiology, diagnosis, and surgical repair’, Compendium on Continuing Education for the Practicing Veterinarian 27, 857–869.
- Griffiths, L.G., Sullivan, M. & Reid, S.W., 2001, ‘A comparison of the effects of unilateral thyroarytenoid lateralization versus cricoarytenoid laryngoplasty on the area of the rima glottidis and clinical outcome in dogs with laryngeal paralysis’, Veterinary Surgery 30, 359–365. http://dx.doi.org/10.1111/j.1532-950X.2001.00359.x, PMid:11443597
- Gross, M.E., Dodam, J.R., Pope, E.R. & Jones, B.D., 2002, ‘A comparison of thiopental, propofol, and diazepam-ketamine anesthesia for evaluation of laryngeal function in dogs premedicated with butorphanol-glycopyrrolate’, Journal of the American Animal Hospital Association 38, 503–506. PMid:12428879
- Hammel, S.P., Hottinger, H.A. & Novo, R.E., 2006, ‘Postoperative results of unilateral arytenoid lateralization for treatment of idiopathic laryngeal paralysis in dogs: 39 cases (1996–2002)’, Journal of the American Veterinary Medical Association 228, 1215–1220. http://dx.doi.org/10.2460/javma.228.8.1215, PMid:16618225
- Harvey, C.E., 1983a, ‘Partial laryngectomy in the dog I. Healing and swallowing function in normal dogs’, Veterinary Surgery 12, 192–196. http://dx.doi. org/10.1111/j.1532-950X.1983.tb00741.x
- Harvey, C.E., 1983b, ‘Partial laryngectomy in the dog II. Immediate increase in glottic area obtained compared with other laryngeal procedures’, Veterinary Surgery 12, 197–201. http://dx.doi.org/10.1111/j.1532-950X.1983.tb00742.x
- Harvey, C.E. & O’Brien, J.A., 1982, ‘Treatment of laryngeal paralysis in dogs by partial laryngectomy’, Journal of the American Animal Hospital Association 18, 551–556.
- Hermanson, J.W. & Evans, H.E., 1993, ‘The muscular system’, in M.E. Miller & H.E. Evans (eds.), Miller’s anatomy of the dog, 3rd edn., pp. 258–384, Saunders, Philadelphia.
- Holt, D. & Harvey, C., 1994, ‘Idiopathic laryngeal paralysis: Results of treatment by bilateral vocal fold resection in 40 dogs’, Journal of the American Animal Hospital Association 30, 389–395.
- Jackson, A.M., Tobias, K., Long, C., Bartges, J. & Harvey, R., 2004, ‘Effects of various anesthetic agents on laryngeal motion during laryngoscopy in normal dogs’, Veterinary Surgery 33, 102–106. http://dx.doi.org/10.1111/j.1532- 950x.2004.04016.x, PMid:15027970
- Jaggy, A., Oliver, J.E., Ferguson, D.C., Mahaffrey, E.A. & Jun, T.G., 1994, ‘Neurological manifestations of hypothyroidism: A retropsective study of 29 dogs’, Journal of Veterinary Medicine 8(5), 328–336.
- Jeffery, N.D., Talbot, C.E., Smith, P.M. & Bacon, N.J., 2006, ‘Acquired idiopathic laryngeal paralysis as a prominent feature of generalised neuromuscular disease in 39 dogs’, Veterinary Record 158, 17–21. http://dx.doi.org/10.1136/vr.158.1.17, PMid:16400098
- Kvitko-White, H., Balog, K., Scott-Moncrieff, J.C., Johnson, A. & Lantz, G.C., 2012, ‘Acquired bilateral laryngeal paralysis associated with systemic lupus erythematosus in a dog’, Journal of the American Animal Hospital Association 48(1), 60–65.
- Kwon, T.K., Jeong, W.J., Sung, M.W. & Kim, K.H., 2007, ‘Development of endoscopic arytenoid adduction using cricoid implant’, Annals of Otology, Rhinology and Laryngology 116, 770–778. PMid:17987783
- LaHue, T.R., 1989, ‘Treatment of laryngeal paralysis in dogs by unilateral cricoarytenoid laryngoplasty’, Journal of the American Animal Hospital Association 25, 317–324.
- MacPhail, C.M. & Monnet, E., 2001, ‘Outcome of and postoperative complications in dogs undergoing surgical treatment of laryngeal paralysis: 140 cases (1985– 1998)’, Journal of the American Veterinary Medical Association 218, 1949–1956. http://dx.doi.org/10.2460/javma.2001.218.1949, PMid:11417740
- MacPhail, C.M. & Monnet, E., 2008, ‘Laryngeal paralysis’, in J.D. Bonagura & R.W. Kirk (eds.), Kirk’s current veterinary therapy, pp. 627–630, Elsevier Saunders, Philadelphia.
- Mahony, O.H., Knowles, K.E., Braund, K.G., Averill, D.R. & Frimberger, A.E., 1998, ‘Laryngeal paralysis-polyneuropathy complex in young Rottweilers’, Journal of Veterinary Internal Medicine 12, 330–337. http://dx.doi. org/10.1111/j.1939-1676.1998.tb02131.x, PMid:9773408
- Mazzaferro, E.M., 2009, ‘Oxygen therapy’, in D.C. Silverstein & K. Hopper (eds.), Small animal critical care medicine, pp. 78–81, Elsevier Saunders, St. Louis. http:// dx.doi.org/10.1016/B978-1-4160-2591-7.10019-0
- Michael, P., 2002, ‘Inflammatory myopathies’, Veterinary Clinics of North America: Small Animal Practice 32, 147–167. http://dx.doi.org/10.1016/S0195- 5616(03)00083-4
- Millard, R.P. & Tobias, K.M., 2009, ‘Laryngeal paralysis in dogs’, Compendium on Continuing Education for the Practicing Veterinarian 31, 212–219.
- Monnet, E. & Tobias, K.M. 2012, ‘Larynx’, in K.M. Tobias & S.A. Johnston (eds.), Veterinary surgery small animal, vol. 2, pp. 1718–1733, Elsevier Saunders, St. Louis.
- Nelissen, P. & White, R.A., 2011, ‘Arytenoid lateralization for management of combined laryngeal paralysis and laryngeal collapse in small dogs’, Veterinary Surgery 41, 261–265. PMid:22103399
- O’Brien, J.A. & Hendriks, J., 1986, ‘Inherited laryngeal paralysis. Analysis in the husky cross’, Veterinary Qauterly 8, 301–302. http://dx.doi.org/10.1080/01652176.198 6.9694059, PMid:3798712
- Olivieri, M., Voghera, S.G. & Fossum, T.W., 2009, ‘Video-assisted left partial arytenoidectomy by diode laser photoablation for treatment of canine laryngeal paralysis’, Veterinary Surgery 38, 439–444. http://dx.doi.org/10.1111/j.1532- 950X.2009.00546.x, PMid:19538663
- Paniello, R.C., West, S.E. & Lee, P., 2001, ‘Laryngeal reinnervation with the hypoglossal nerve. I. Physiology, histochemistry, electromyography, and retrograde labeling in a canine model’, Annals of Otology, Rhinology and Laryngology 110, 532–542. PMid:11407844
- Parnell, N.K., 2010, ‘Diseases of the throat’, in S.J. Ettinger & E.C. Feldman (eds.), Textbook of veterinary internal medicine: Diseases of the dog and the cat, 7th edn., vol. 1, pp. 1040–1047, Elsevier Saunders, St. Louis.
- Polizopoulou, Z.S., Koutinas, A.F., Papadopoulos, G.C. & Saridomichelakis, M.N., 2003, ‘Juvenile laryngeal paralysis in three Siberian husky x Alaskan malamute puppies’, Veterinary Record 153, 624–627. http://dx.doi.org/10.1136/vr.153.20.624, PMid:14653342
- Radlinsky, M.G., Mason, D.E. & Hodgson, D., 2004, ‘Transnasal laryngoscopy for the diagnosis of laryngeal paralysis in dogs’, Journal of the American Animal Hospital Association 40, 211–215. PMid:15131101
- Radlinsky, M.G, Williams, J., Frank, P.M. & Cooper, T.C., 2009, ‘Comparison of three clinical techniques for the diagnosis of laryngeal paralysis in dogs’, Veterinary Surgery 38, 434–438. http://dx.doi.org/10.1111/j.1532-950X.2009.00506.x, PMid:19538662
- Rice, D.H., 1982, ‘Laryngeal reinnervation’, Laryngoscope 92, 1049–1059. http:// dx.doi.org/10.1288/00005537-198209000-00016, PMid:7121159
- Ridyard, A.E., Corcoran, B.M., Tasker, S., Willis, R., Welsh, E.M., Demetriou, J.L. et al., 2000, ‘Spontaneous laryngeal paralysis in four white-coated German shepherd dogs’, Journal of Small Animal Practice 41, 558–561. http://dx.doi. org/10.1111/j.1748-5827.2000.tb03153.x, PMid:11138855
- Ross, J.T., Matthiesen, D.T., Noone, K.E. & Scavelli, T.A., 1991, ‘Complications and long-term results after partial laryngectomy for the treatment of idiopathic laryngeal paralysis in 45 dogs’, Veterinary Surgery 20, 169–173. http://dx.doi.org/10.1111/ j.1532-950X.1991.tb00330.x, PMid:1853548
- Rudorf, H., Barr, F.J. & Lane, J.G., 2001, ‘The role of ultrasound in the assessment of laryngeal paralysis in the dog’, Veterinary Radiology and Ultrasound 42, 338–343. http://dx.doi.org/10.1111/j.1740-8261.2001.tb00949.x, PMid:11499709
- Schofield, D.M., Norris, J. & Sadanaga, K.K., 2007, ‘Bilateral thyroarytenoid cartilage lateralization and vocal fold excision with mucosoplasty for treatment of idiopathic laryngeal paralysis: 67 dogs (1998–2005)’, Veterinary Surgery 36(6), 519–525. http://dx.doi.org/10.1111%2Fj.1532-950X.2007.00302.x
- Shelton, G.D., 2002, ‘Myasthenia gravis and disorders of neuromuscular transmission’, Veterinary Clinics of North America: Small Animal Practice 32(1), 189–206.
- Smith, M.M., 2000, ‘Diagnosing laryngeal paralysis’, Journal of the American Animal Hospital Association 36, 383–384. PMid:10997511
- Snelling, S.R. & Edwards, G.A., 2003, ‘A retrospective study of unilateral arytenoid lateralisation in the treatment of laryngeal paralysis in 100 dogs (1992–2000)’, Australian Veterinary Jouranl 81, 464–468. http://dx.doi. org/10.1111/j.1751-0813.2003.tb13361.x, PMid:15086080
- Stanley, B.J., Hauptman, J.G., Fritz, M.C., Rosenstein, D.S. & Kinns, J., 2010, ‘Esophageal dysfunction in dogs with idiopathic laryngeal paralysis: A controlled cohort study’, Veterinary Surgery 39, 139–149. http://dx.doi.org/10.1111/j.1532- 950X.2009.00626.x, PMid:20210960
- Tobias, K.M., Jackson, A.M. & Harvey, R.C., 2004, ‘Effects of doxapram HCl on laryngeal function of normal dogs and dogs with naturally occurring laryngeal paralysis’, Veterinary Anaesthesia and Analgesia 31, 258–263. http://dx.doi.org/10.1111/ j.1467-2995.2004.00168.x, PMid:15509290
- Trout, N.J., Harpster, N.K., Berg, J. & Carpenter, J., 1994, ‘Long-term results of uliateral ventriculocordectomy and partial arytenoidectomy for the treatment of laryngeal paralysis in 60 dogs’, Journal of the American Animal Hospital Association 30, 401–407.
- Turner, D.M. & Ilkiw, J.E., 1990, ‘Cardiovascular and respiratory effects of three rapidly acting barbiturates in dogs’, American Journal of Veterinary Research 51, 598– 604. PMid:2327623
- Venker-van Haagen, A.J., 1982, ‘Laryngeal paralysis in bouviers Belge des Flandres and breeding advice to prevent this condition’, Tijdschrift voor Diergeneeskunde 107, 21–22. PMid:7054920
- Weinstein, J. & Weisman, D., 2010, ‘Intraoperative evaluation of the larynx following unilateral arytenoid lateralization for acquired idiopathic laryngeal paralysis in dogs’, Journal of the American Animal Hospital Association 46, 241–248. PMid:20610696
- White, R.A.S., 1989, ‘Unilateral arytenoid lateralisation: An assessment of technique and long term results in 62 dogs with laryngeal paralysis’, Journal of Small Animal Practice 30, 543–549. http://dx.doi.org/10.1111/j.1748-5827.1989.tb01469.x
- Yeon, S.C., Lee, H.C., Chang, H.H. & Lee, H.J., 2005, ‘Sound signature for identification of tracheal collapse and laryngeal paralysis in dogs’, Journal of Veterinary Medical Science 67, 91–95. http://dx.doi.org/10.1292/jvms.67.91, PMid:15699602
- Zikes, C. & McCarthy, T., 2012, ‘Bilateral ventriculocordectomy via ventral laryngotomy for idiopathic laryngeal paralysis in 88 dogs’, Journal of the Amercian Animal Hospital Association 48(4), 234–244. http://dx.doi.org/10.5326%2FJAAHA-MS-5751






